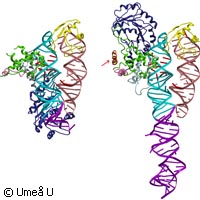
Las moléculas proteínicas portan una «etiqueta» que determina su destino
En un estudio publicado recientemente en la revista Nature Structural and Molecular Biology, investigadores de la Universidad de Umeå (Suecia) muestran de qué manera se asegura una correcta distribución de las proteínas en el interior de las células. Su trabajo ofrece un panorama detallado según el cual las proteínas están dotadas de una especie de etiqueta que permite guiarlas a través de la membrana celular. La mayoría de los organismos de estructura compleja se componen de un número incontable de células de formas muy complejas. Las células presentan una organización muy sofisticada que se debe en gran medida a que las diversas proteínas de su interior se distribuyen correctamente y se colocan allí donde deben. Se trata de un mecanismo extraordinario que despierta gran interés científico. Si se pudiera desentrañar el sistema por el que se determina el lugar en el que cada proteína debe ubicarse en el interior de la célula y cuáles de dichas proteínas se deben exportar, surgiría la posibilidad de rediseñar el sistema para obtener ventajas. Sin embargo, el mecanismo por el que las distintas familias de proteínas se «despachan» a su destino adecuado dentro de la célula sigue siendo una de las cuestiones más intrigantes para la biología. Se desconoce incluso el primer paso de todos: el proceso, extraño en apariencia, por el que los polipéptidos atraviesan el interior denso e impermeable de la membrana del retículo endoplasmático. No obstante, sí que se conocen algunos de los principios fundamentales de este proceso. Recientemente estos investigadores de Umeå lograron explicar de qué manera las proteínas se exportan incluso por completo fuera de la célula. El primer paso de la «maquinaria de exportación» se basa en un complejo molecular. Éste se compone de una pequeña molécula de ácido ribonucleico (ARN) entrelazado con cinco polipéptidos específicos. En su conjunto estos constituyen una partícula de reconocimiento de señal (SRP). Este complejo localiza y se combina con aquellas proteínas que se deben exportar. Además de la SRP, se ha descubierto otro principio que se encuentra esencialmente en la misma forma en todas las células: la «etiqueta de dirección». Al parecer, las células se guían por secuencias cortas de aminoácidos, componentes básicos de las proteínas, que ejercen la función de etiqueta indicativa del destino definitivo de éstas. Sin esta secuencia señalizadora, una proteína no puede interactuar con la SRP ni atravesar el retículo endoplasmático. Esta señal en particular es eliminada en el proceso de traspaso de la membrana, tras lo cual entra en juego otra señal. Otras secuencias de aminoácidos también pueden actuar como señal para etapas posteriores de clasificación, y esto plantea un tema de investigación apasionante. Ya se conoce una de estas etiquetas peptídicas adicionales: las secuencias de anclaje. Éstas se suelen hallar en el extremo de las proteínas. Compuestas por aminoácidos hidrofóbicos, intervienen para fijar las proteínas firmemente a las membranas. Curiosamente algunas secuencias de anclaje no funcionan más que en su destino definitivo, es decir, fuera de la membrana del retículo endoplasmático o de cualquier otra membrana que se encuentre a lo largo de la ruta de exportación. Estos complicados mecanismos se producen en las células de todos los animales y las plantas, pero hay cierto organismo que es mucho más simple, Methanococcus jannaschii, un organismo autotrópico hipertermófilo perteneciente al reino de las arqueobacterias. Este microorganismo unicelular facilitó a los científicos de la Universidad de Umeå un sistema modelo más sencillo en el que estudiar la estructura de la SRP con y sin la secuencia señalizadora guía. La técnica que emplearon se denomina cristalografía de rayos X. «Los cambios estructurales eran considerablemente mayores de lo que se había previsto», explicó Elisabeth Sauer-Eriksson, profesora en el Departamento de Química de la Universidad de Umeå. «Nos ofrecen explicaciones detalladas de la función de las SRP en el trasporte proteínico. Estas especificaciones estructurales también pueden servir de modelo de cómo las SRP funcionan a varios niveles durante el transporte de las proteínas.» Si pudieran desentrañarse los ingeniosos mecanismos mediante los que las células etiquetan y clasifican sus proteínas para su exportación, los especialistas en ingeniería genética podrían inducir que los microorganismos secretaran la proteína que quisieran. Este estudio fue financiado por el Consejo Sueco de Investigación, el Centro de Investigación Microbiana de la Universidad de Umeå y la Fundación Kempe.Para más información, consulte: Universidad de Umeå http://www.umu.se/english/(se abrirá en una nueva ventana) Nature Structural and Molecular Biology http://www.nature.com/nsmb/index.html(se abrirá en una nueva ventana)