Un petit renégat pour vaincre la tuberculose?
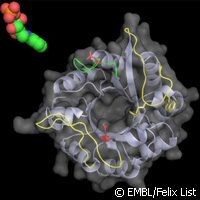
Des chercheurs financés par l'UE du Laboratoire européen de biologie moléculaire (LEBM) à Hambourg, en Allemagne ont éclairé sous un autre angle le mécanisme des enzymes d'un groupe particulier de bactéries qui inclut le Mycobacterium tuberculosis (Mtb), la bactérie responsable de la tuberculose (TB). Publiés dans la revue Proceedings of the National Academy of Sciences (PNAS), ces résultats pourraient détenir la clé pour de nouvelles thérapies ciblées. Dans le cadre de cette étude, l'équipe LEBM, conduite par le Dr Matthias Wilmanns, s'est concentrée sur la capacité intrigante de la bactérie à produire de l'histidine (His) et du tryptophane (Trp), deux acides aminés essentiels, à l'aide d'un enzyme simple. Cette fonction lui confère une place différente par rapport à la plupart des autres organismes, qui ont besoin de deux enzymes différentes pour effectuer le travail. À la place des enzymes HisA et TrpF, Mtb utilise juste une enzyme pour catalyser les deux réactions. Cette enzyme multitâche, connue sous le nom de PriA, peut reconnaître et se lier à deux molécules différentes, ou substrats. Comment y parvient-elle? «Lorsque nous avons résolu la structure tridimensionnelle de PriA», affirme le Dr Wilmanns, «nous avons découvert sa capacité unique à former deux sites différents actifs spécifiques au substrat. Elle peut former un site actif de réaction spécifique, ou être soumise à ce qu'on appelle une 'métamorphose induite par le substrat' pour former un différent site actif.» À la prochaine étape, l'équipe a balayé 20 000 composants moléculaires et en a identifié de nombreux qui inhibent les réactions catalysées à PriA sans affecter le TrpF. La recherche a été en partie financée par le projet SYSTEMTB («Systems biology of Mycobacterium tuberculosis»), qui s'est vu alloué plus de 10,5 millions d'euros au titre du thème Santé du septième programme-cadre (7e PC) de l'UE pour créer un cadre permettant de comprendre les caractéristiques clés de Mtb et ses interactions avec l'hôte. Le consortium de SYSTEMTB est composé d'experts des domaines de la recherche et de l'industrie de République tchèque, de France, d'Italie, d'Allemagne, des Pays-Bas, de Pologne, d'Espagne, de Suisse et du Royaume-Uni. Les efforts combinés des partenaires de SYSTEMTB devraient offrir de nouvelles informations et permettre d'élaborer de nouvelles stratégies à bon rapport coût-efficacité - des avancées qui devraient représenter une contribution précieuse aux efforts du monde à lutter contre la TB. Selon les estimations de l'Organisation mondiale de la santé (OMS), un tiers de la population mondiale est infectée par le bacille. Cela est inquiétant, estiment les experts, même si pas plus qu'une personne infectée sur 10 a des chances de développer la maladie - et en effet, la TB se développe facilement sur un système immunitaire affaibli, le risque est plus élevé pour les individus atteints du VIH/SIDA. L'action mondiale pour contrôler la maladie a donné des résultats remarquables, mais l'on estime toutefois que la TB a coûté la vie à 1,7 millions de personnes à travers le monde en 2009. Les efforts mondiaux à renverser cette situation ne sont pas évidents car la maladie elle-même se défend. De nouvelles souches de plus en plus résistantes aux médicaments ont émergé, et de nouveaux traitements et stratégies de traitement sont nécessaires pour maintenir tout cela à un niveau stable. Ils seront, fort probablement, fondés sur des initiatives telles que celles présentées par le Dr Wilmanns et son équipe. «Nous estimons que cette capacité de catalyse bi-substrat au sein du Mycobacterium tuberculosis pourrait être une nouvelle opportunité pour le développement des médicaments à venir», affirme-t-il. «Ce processus de réaction spécifique à l'organisme pourrait être exploité, étant donné que seul le pathogène et aucune des autres bactéries vivant dans ou sur les humains (parmi lesquelles nombreuses sont importantes à notre bien-être) pourrait être ciblé.» L'institut Leibniz de pharmacologie moléculaire à Berlin, en Allemagne a apporté sa contribution à cette étude. Pour de plus amples informations, consulter: Laboratoire européen de biologie moléculaire (LEBM): http://www.embl.de(s’ouvre dans une nouvelle fenêtre) Fiche d'information du projet SystemeTB sur CORDIS, veuillez cliquer: ici Fiche d'information de l'OMS sur la tuberculose, veuillez cliquer: ici(s’ouvre dans une nouvelle fenêtre) PNAS: http://www.pnas.org/content/early/2011/02/09/1015996108.abstract//RMK(s’ouvre dans une nouvelle fenêtre)
Pays
Allemagne