Une technologie sophistiquée met en lumière le processus de repliement défectueux de protéines
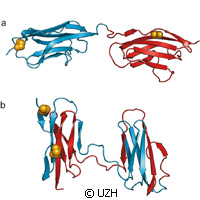
Le repliement de protéines est nécessaire pour le fonctionnement de structures tridimensionnelles dans l'organisme. Toutefois, il arrive que certaines parties des protéines fonctionnelles ne se replient pas, menant ainsi à des conditions débilitantes telles que les maladies neurodégénératives. Des chercheurs de Suisse et du Royaume-Uni ont étudié le repliement de protéines en utilisant une technique spectroscopique sophistiquée. Présentée dans la revue Nature, l'étude révèle comment le repliement défectueux peut se déclencher dans des protéines contenant de nombreux domaines. Les travaux ont été en partie financés par une bourse Marie Curie au titre du septième programme-cadre (7e PC) de l'UE. Les chercheurs des universités de Zurich et de Cambridge expliquent que le repliement défectueux se déclenche plus fréquemment lorsque la séquence d'acides aminés dans les protéines environnantes est très fréquente. Les experts expliquent que les protéines sont les principales machines moléculaires de nos organismes. Elles tiennent plusieurs rôles; elles procèdent au traitement des nutriments et transforment l'énergie, mais elles contribuent également à la structure cellulaire et à la transmission de signaux au niveau des cellules et du corps entier. Les protéines doivent adopter une structure tridimensionnelle bien définie pour assurer la bonne performance de leurs fonctions spécifiques, et pour la plupart, cette structure est spontanée lorsqu'elles se sont formées à partir de leurs bases individuelles, les acides aminés, sous la forme de longue chaîne de molécules dans la cellule. Mais une erreur au niveau du repliement empêche les protéines de mener à bien leurs fonctions. Ainsi, de nombreux troubles peuvent se manifester, mais éviter ce repliement défectueux est une tâche relativement hardue. Les mêmes interactions moléculaires qui stabilisent la structure correcte des protéines individuelles peuvent déclencher des interactions entre molécules protéiques et les forcer à se replier de manière erronnée. En utilisant la méthode de fluorescence de molécules simples, l'équipe a évalué ce qui se passe lors d'un repliement défectueux. Ils ont sondé les domaines, ou sections, de titine (ou connectine), l'une des plus grandes protéines de l'organisme. Cette dernière contribue à la stabilité et l'élasticitié des fibres musculaires. Les domaines individuels de titine peuvent se déplier lorsqu'un muscle est très demandé pour éviter que les tissus ne s'endommagent. Mais lorsqu'il se relâche, cela peut entraîner un repliement défectueux pour les domaines. L'équipe a attaché de minuscules molécules de teinture en tant que sondes dans les protéines pour les besoins de l'étude. «En utilisant la méthode de laser spectroscopique, nous sommes en mesure de déterminer les distances à l'échelle moléculaire, à savoir jusqu'à quelques millionièmes de millimètre, par le transfert d'énergie entre les sondes», commente l'un des auteurs de l'étude, le professeur Benjamin Schuler de l'université de Zurich. Ainsi, l'équipe a pu correctement identifier les structures et distinguer les protéines qui s'étaient mal repliées, obtenant ainsi une proportion du repliement défectueux. «L'étude de différents domaines de titine dans nos expériences a révélé que la probabilité d'un repliement défectueux augmente si les domaines environnants possèdent des séquences d'acides aminés très similaires», explique-t-il. «Il s'agirait d'une stratégie évolutive pour éviter ce phénomène et ainsi garantir leur fonctionnalité maximum.»Pour de plus amples informations, consulter: Nature: http://www.nature.com/(s’ouvre dans une nouvelle fenêtre) Université de Zurich: http://www.uzh.ch/index_en.html(s’ouvre dans une nouvelle fenêtre)
Pays
Suisse, Royaume-Uni