Optisch induzierte gezielte Wirkstofffreisetzung
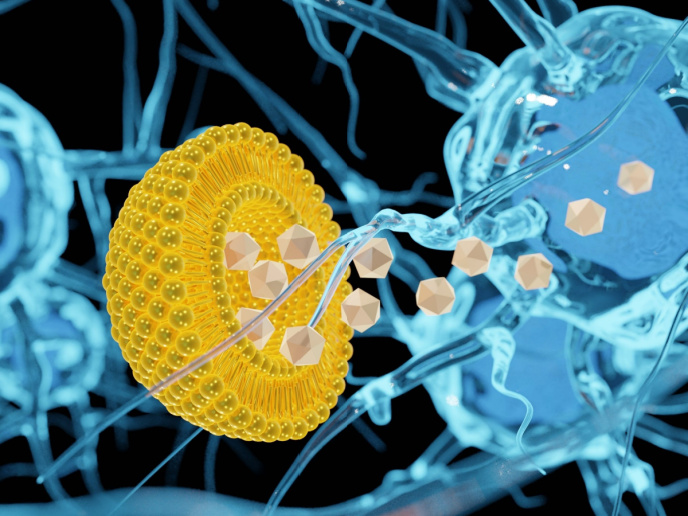
Die Wissenschaftler arbeiteten primär mit UV-Strahlung, um gebundene Moleküle aus den Trägern freizusetzen und biologische Zielstrukturen mit hoher räumlicher und zeitlicher Empfindlichkeit zu behandeln. Allerdings ist die für viele therapeutische oder diagnostische (theragnostische) Anwendungen nötige Eindringtiefe bei UV-Licht begrenzt, auch wird es stark absorbiert, was zu unerwünschten Schäden am Gewebe führt. Beides schränkt die Anwendbarkeit in vivo deutlich ein. Dem widmete sich nun das EU-finanzierte Projekt "Self-assembled thermo-nanoprobes on hollow gold nanoparticles for theragnostic applications" (TNP-HGNS). Um theragnostische Moleküle freizusetzen, wurden hohle Gold- und Silbernanostrukturen (Würfel, Käfige und Kugeln) mit NIR-Licht bestrahlt, dessen Eindringtiefe höher ist und das nur minimal absorbiert wird. Gold und Silber reichern sich in Geweben an, absorbieren intensiv NIR-Strahlung, sind optisch einstellbar und einfach zu funktionalisieren. Zudem prädestiniert sie ihre niedrige Reaktivität und Toxizität für biologische Anwendungen. Wenn diese hohlen Metallnanostrukturen NIR-Strahlung absorbieren, spaltet die dadurch entstehende Wärmeenergie chemische Bindungen in den thermolabilen Substanzen (Veränderung der Zusammensetzung durch Wärmeeinwirkung). Entwickelt wurden Methoden zur Herstellung und Funktionalisierung thermolabiler Gold- und Silbernanostrukturen, die zuerst mit einem Farbstoff getestet und dann mit dem Krebsmedikament Doxorubicin (Dox) angewendet wurden. In vitro wurde die Freisetzung von Dox und Verringerung der Lebensfähigkeit von MCF7-Brustkrebszellen geprüft. Sowohl mit kontinuierlicher Welle-Befeldung (continuous wave, CW) wie auch Nanosekundenlaserpulsen nahm die Lebensfähigkeit der Zellen deutlich ab. Mit einem Zwei-Watt-CW-Laser wurde etwa die Hälfte der Zellen eliminiert, gepulste Bestrahlung mit 320 Milliwatt (mW) töte sogar 80 % der Krebszellen ab. Mit der optischen Freisetzung von Molekülen in vivo bieten sich viele Möglichkeiten für die gezielte Theragnostik. TNP-HGNS lieferte damit eine neue Methode zur Freisetzung von Wirkstoffen mittels NIR-Spektroskopie, die die Lebensfähigkeit von Krebszellen in vitro deutlich senkt. Die Studie ist ein echter Durchbruch und ebnet den Weg für weitere Forschungen und klinische Studien, um die Diagnostik und Behandlung bedeutsamer Krankheiten voranzutreiben. In dreizehn Fachbeiträgen wurden die Ergebnisse inzwischen auf breiter Basis vorgestellt.