Apprendre de la nature
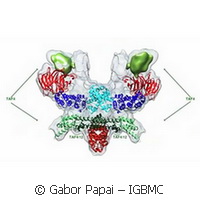
Une équipe de recherche du Laboratoire européen de biologie moléculaire de Grenoble et de l'Institut de génétique et de biologie moléculaire et cellulaire (IGBMC) de Strasbourg ont réussi, pour la première fois, à décrire en détail moléculaire l'architecture de TFIID, la molécule clé du processus de transcription de l'ADN en ARNm. La TFIID est un complexe multiprotéique à l'échelle mégadaltonique composé de protéine de liaison à TATA (TBP) et 13 facteurs associés à TBP (les TAF). Malgré son rôle crucial, l'architecture détaillée et le mécanisme d'assemblage de TFIID n'ont jamais été compris. Mais les chercheurs des deux institutions ont appliqué des méthodes innovantes pour y parvenir. Les scientifiques ont exprimé simultanément toutes les protéines d'un complexe dans des cellules d'insecte, grâce à l'insertion des gènes correspondants dans un baculovirus. Cela a ouvert la voie à de nouvelles perspectives dans l'étude de transcription et de la structure et du mécanisme d'autres assemblages multiprotéiques impliqués dans la régulation génétique. «Récemment, nous avons développé notre système MultiBac, qui utilise un baculovirus recombinant spécialement conçu pour exprimer les protéines de complexes, et de nombreux chercheurs du monde entier appliquent cette méthode avec succès pour produire des échantillons biologiques complexes qui ne peuvent être fabriqués autrement», commente Imre Berger, responsable de l'étude pour le LEBM de Grenoble. «Mais pour nos complexes de TFIID, cette méthode ne suffisait pas.» Les scientifiques ont compris que les cellules de culture d'insecte infectées par un baculovirus recombinant étaient incapables de produire des TAF de manière équilibrée. Mais plutôt, certains possédaient des TAF en trop grand nombre, d'autres moins, entraînant des complexes malformés. La solution au problème provient de l'étude de la stratégie de certains virus, comme le coronavirus, à fabriquer leur protéines. Lorsque le coronavirus se réplique, il produit un grand nombre de polyprotéines qui sont décomposées par une protéase hautement spécifique en enzymes individuelles et en facteurs protéiques nécessaires au coronavirus. «Il existe de nombreuses théories se basant sur des données rares, tentant de rationaliser comment ce complexe essentiel est formé», explique Christoph Bieniossek, premier auteur de l'étude. «Nos analyses montrent qu'aucune des théories n'est correcte. La manière dont les TAF s'assemblent est bien plus complexe que ce que l'on pensait.» Les auteurs décrivent que le coeur de TFIID, qui est parfaitement symétrique, devient asymétrique lorsque de nouvelles sous-unités de TAF s'y greffent pour produire un holo-TFIID complet. Deux sous-unités, importées séparément dans le noyau, se greffent exactement dans l'axe présent dans le coeur de TFIID, entraînant un réarrangement structurel dans une seule moitié du complexe. Par ce mécanisme simple bien que complexe, les deux moitiés du complexe auparavant identiques adoptent différentes formes, et l'asymétrie résultant se propage jusqu'à ce qu'un complexe holo-TFIID fonctionnel est formé. «Ces travaux sont le résultat de nombreuses années d'efforts intensifs, et ils n'ont pu être possibles que grâce à cette fructueuse collaboration avec nos collègues de l'IGBMC qui sont experts en recherche sur les facteurs de transcription humains», conclut Imre Berger. «Nous savons désormais à quoi ressemble le coeur de TFIID et ce qui se passe lorsque des TAF supplémentaires s'y greffent. Nous pensons avoir ouvert la voie à une meilleure compréhension de l'architecture du complexe TFIID entier dans un futur proche, de même que pour les autres assemblages multiprotéiques impliqués dans la régulation génétique, et pourrons expliquer leur rôle dans la fonction biologique de la catalyse.» L'étude, publiée dans la revue Nature today, impliquait les groupes de recherche d'Imre Berger et de Christiane Schaffitzel du LEBM de Grenoble et les groupes de recherche de Patrick Schultz et de Laszlo Tora de l'IGBMC de Strasbourg. La plateforme technologique MultiBac utilisée dans l'étude est le fondement du projet ComplexINC, financé par le 7e PC de l'UE.Pour plus d'informations, veuillez consulter: LEBM de Grenoble http://www.embl-grenoble.fr(s’ouvre dans une nouvelle fenêtre) Projet ComplexINC http://complexinc.eu/innovation/(s’ouvre dans une nouvelle fenêtre)