Aprender de la Naturaleza
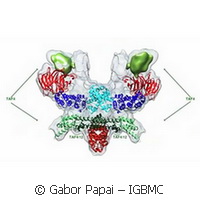
Un equipo de científicos del Laboratorio Europeo de Biología Molecular, sito en Grenoble (Francia), y del Institut de Génétique et de Biologie Moléculaire et Cellulaire (IGBMC, Estrasburgo) ha logrado por primera vez describir con precisión molecular la estructura del andamiaje central del TFIID humano, el complejo proteico esencial para la transcripción de ADN a ARNm. El TFIID humano es un complejo multiproteico con un tamaño del orden de megadaltones que se compone de proteínas de unión a la caja TATA (TBP) y trece factores asociados a TBP (TAF). Pese a su importancia determinante, seguía sin conocerse con precisión su arquitectura y mecanismo de ensamblaje. Pero esto se ha logrado por fin aplicando métodos innovadores. Los científicos obtuvieron cultivos de células de insecto que infectaron con un baculovirus modificado exprofeso para producir su propio complejo TFIID en la cantidad y con la calidad necesarias para la realización de estudios detallados. Este logro ha abierto nuevas perspectivas en el estudio de la transcripción y de la estructura y el mecanismo de otros complejos multiproteicos grandes implicados en la regulación génica. «Hace un tiempo ya desarrollamos el sistema Multibac, que se vale de un baculovirus recombinante modificado para el caso con el fin de expresar complejos proteicos. Muchos investigadores de todo el mundo lo aplicaron con éxito para obtener muestras biológicas complejas que antes les resultaba imposible obtener», declaró Imre Berger, asociada al EMBL de Grenoble y coordinadora del estudio. «Pero en el caso de nuestros complejos TFIID humanos, ni siquiera este método de gran eficacia era satisfactorio.» Los científicos se percataron de que los cultivos de las células de insectos infectadas con el baculovirus recombinante, sencillamente, eran incapaces de producir los TAF de un modo equilibrado. Algunos se producían en grandes cantidades y otros en cantidades bajas, a raíz de lo cual el complejo no se formaba adecuadamente. La solución a este impasse se logró estudiando la estrategia empleada por ciertos virus, como el coronavirus, para producir sus proteínas. Cuando el coronavirus se replica, produce poliproteínas muy grandes que posteriormente son separadas por una proteasa altamente especializada e introducidas en los enzimas y los factores proteicos que este virus necesita. «Se habían formulado varias tesis, basadas en los escasos datos disponibles, que trataban de racionalizar la manera en que se articula este complejo esencial», explicó Christoph Bieniossek, primer firmante del estudio. «Nuestros análisis muestran que, básicamente, ninguna de esas tesis era correcta. Resultó que el mecanismo de ensamblaje de los TAF era mucho más complejo de lo que se pensaba.» Los autores describieron al detalle la manera en que este complejo central TFIID, que según observaron tiene una simetría partida en dos, se vuelve asimétrico al crecer adquiriendo nuevos TAF hasta llegar a un holo-TFIID completo. Dos subunidades importadas por separado al núcleo se unen exactamente por el eje de desdoble que existe en el núcleo de TFIID, dando lugar así a grandes reorganizaciones estructurales, pero sólo en una mitad del complejo. Con este mecanismo sencillo y elegante, las dos mitades del complejo, antes idénticas, cobran formas distintas. La asimetría resultante se propaga posteriormente hasta que se forma el complejo holo-TFIID funcional. «Este trabajo es fruto de muchos años de intenso trabajo. Sólo fue posible gracias a esta fructífera y apasionante colaboración con nuestros colegas del IGBMC, líderes en la investigación sobre factores de transcripción humanos», concluyó Imre Berger. «Hasta cierto punto, conocemos el aspecto del núcleo del TFIID y lo que ocurre cuando se unen TAF adicionales. En nuestra opinión, hemos abierto la puerta a la posibilidad de descubrir la arquitectura del complejo TFIID humano al completo en un futuro próximo, así como los otros complejos grandes multiproteicos implicados en la regulación de los genes, y de explicar sus respectivas funciones en cuanto a catalizar la función biológica.» Este estudio, publicado en la revista Nature, es fruto de la colaboración de los grupos de investigación de Imre Berger y Christiane Schaffitzel, del EMBL de Grenoble, y de los grupos de investigación de Patrick Schultz y Laszlo Tora, del IGBMC de Estrasburgo. La plataforma tecnológica MultiBac utilizada en este estudio es uno de los pilares del proyecto ComplexINC, financiado mediante el 7PM de la Comisión Europea.Para más información, consulte: EMBL de Grenoble: http://www.embl-grenoble.fr(se abrirá en una nueva ventana) Proyecto ComplexINC: http://complexinc.eu/innovation/(se abrirá en una nueva ventana)