Von der Natur lernen
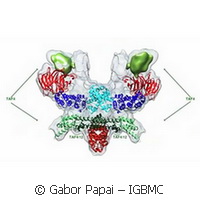
Einer Forschungsgruppe des Europäischen Labors für Molekularbiologie in Grenoble und des Institut de Génétique et de Biologie Moléculaire et Cellulaire (IGBMC) in Straßburg ist es zum ersten Mal gelungen, die Architektur des zentralen Gerüsts menschlicher TFIID, dem Proteinkomplex, der für die Transkription von DNA zu mRNA essentiell ist, im molekularen Detail zu beschreiben. Das menschliche TFIID ist ein Megadalton-großer Multiproteinkomplex, der aus einem TATA-Box-bindenden Protein (TBP) und 13 TBP-assoziierten Faktoren (TAFs) zusammengesetzt ist. Trotz seiner entscheidenden Rolle, bleiben die detaillierte Architektur und der Aufbaumechanismus von TFIID schwer fassbar. Dies wurde durch den Einsatz innovativer Methoden erreicht. Wissenschaftler brachten Kulturen von Insektenzellen, die sie mit einem speziell entworfenen Baculovirus infiziert hatten,dazu, ihren TFIID-Komplex in der für detaillierte Studien erforderlichen Qualität und Quantität zu produzieren. Dadurch eröffneten sich neue Perspektiven für das Studium der Transkription, der Struktur und der Mechanismen anderer großer Multi-Proteinkomplexe, die an der Genregulation beteiligten sind. "Vor einiger Zeit entwickelten wir unser MultiBac-System, das einen angepassten rekombinanten Baculovirus verwendet, um Protein-Komplexe zu erklären. Viele Forscher auf der ganzen Welt haben diesen sehr erfolgreich angewandt, um komplizierte biologische Proben herzustellen, was vorher nicht möglich war" , so Imre Berger, der die Studie am EMBL Grenoble leitete. "Für unsere menschlichen TFIID-Komplexe war selbst diese erfolgreiche Methode einfach nicht gut genug." Die Wissenschaftler erkannten, dass die mit gentechnisch hergestelltem Baculovirus infizierten Zellkulturen nicht in der Lage waren, TAFs in ausgewogener Weise zu produzieren. Stattdessen wurden einige TAFs in großen Mengen produziert, und andere in sehr geringen, sodass sich der Komplex nicht ordnungsgemäß bilden konnte. Durch das Studium der Strategie wie bestimmte Viren, etwa das Coronavirus, ihre Proteine herstellen, konnte eine Lösung für dieses Problem entwickelt werden. Wenn sich das Coronavirus repliziert, produziert es sehr große Polyproteine, die dann durch eine sehr spezifische Protease in die einzelnen Enzyme und Proteinfaktoren aufgeteilt werden, die das Coronavirus benötigt. "Es gab zahlreiche Theorien, die sich auf spärliche Daten stützten und die verstehen wollten, wie dieser wesentliche Komplex zusammenhält", erklärt Christoph Bieniossek, Erstautor der Studie. "Unsere Analysen zeigen, dass grundsätzlich keine dieser Theorien richtig war. Die Art und Weise, wie sich die TAFs zusammenfügen, ist sehr viel komplexer als bisher angenommen wurde." Die Autoren beschreiben ferner, wie dieser TFIID- Kernkomplex, der eine zweifache Symmetrie hat, asymmetrisch wird, wenn er durch weitere TAFs auf seinem Weg zum vollständigen Holo-TFIID wächst. Zwei Untereinheiten, die separat in den Kern eingeführt werden, binden genau an der zweifachen Achse im TFIID-Kern, was aber nur in der einen Hälfte des Komplexes zu großen Strukturumlagerungen führt. Durch diesen einfachen, aber eleganten Mechanismus, nehmen die beiden Hälften des Komplexes, die zuvor identisch waren, unterschiedliche Formen an und die resultierende Asymmetrie wird dann weitergegeben, bis der funktionelle Holo-TFIID-Komplex fertiggestellt ist. "Diese Arbeit ist das Ergebnis von vielen Jahren intensiver Forschungsbemühungen und war nur in dieser fruchtbaren und spannenden Zusammenarbeit mit unseren Kollegen am IGBMC möglich, die in der Erforschung der humanen Transkriptionsfaktoren Spitze sind", schließt Imre Berger. "Wir wissen nun genauer, wie der Kern des TFIID aussieht, und was passiert, wenn weitere TAFs gebunden werden. Wir glauben, dass wir die Tür zur Erarbeitung der Architektur des gesamten menschlichen TFIID- Komplexes geöffnet haben, und ebenso für die anderen großen Multiprotein-Baugruppen, die an der Genregulation beteiligt sind, und wir ihre Rollen bei der Katalyse biologische Funktion erklären." Die Studie, die in der Fachzeitschrift Nature veröffentlicht wurde, umfasste Forschungsgruppen von Imre Berger und Christiane Schaffitzel am EMBL Grenoble und die Forschungsgruppen von Patrick Schultz und Laszlo Tora am IGBMC in Straßburg. Die MultiBac-Technologieplattform, die in dieser Studie verwendet wurde, ist ein Eckpfeiler des ComplexINC-Projekts des RP7 der Europäischen Kommission.Weitere Informationen sind abrufbar an der: EMBL Grenoble http://www.embl-grenoble.fr(öffnet in neuem Fenster) ComplexINC project http://complexinc.eu/innovation/(öffnet in neuem Fenster)