Lekcje u matki natury
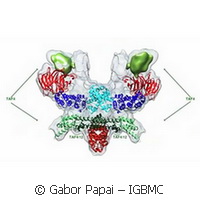
Zespołowi naukowców z Europejskiego Laboratorium Biologii Molekularnej w Grenoble i Institut de Génétique et de Biologie Moléculaire et Cellulaire (IGBMC) w Strasburgu po raz pierwszy udało się opisać w molekularnych szczegółach architekturę centralnego rusztowania ludzkiego TFIID - kompleksu białkowego nieodzownego w transkrypcji z DNA na mRNA. Ludzki TFIID to megadaltonowy kompleks białkowy złożony z białka wiążącego TATA (TBP) i 13 czynników towarzyszących TBP (TAF). Mimo jego kluczowej roli, szczegółowa architektura i mechanizm składania TFIID pozostawały nieuchwytne. Dzięki innowacyjnym metodom udało się je opisać. Naukowcy doprowadzili hodowle komórek owadzich, które zarazili specjalnie zaprojektowanym bakulowirusem, do wytworzenia własnego kompleksu TFIID, którego jakość i ilość wystarczyły do przeprowadzenia szczegółowych badań. W ten sposób otworzyły się nowe perspektywy przed pracami badawczymi nad budową i mechanizmem innych, dużych wielobiałkowych kompleksów w regulacji genów. "Jakiś czas temu opracowaliśmy system MultiBac oparty na specjalnie zmodyfikowanym rekombinacyjnym bakulowirusie do ekspresji kompleksów białkowych, który wykorzystało z powodzeniem wielu naukowców na świecie do uzyskania złożonych próbek biologicznych, które wcześniej były nieosiągalne" - zauważa Imre Berger, który kierował pracami z ramienia EMBL Grenoble. "Jednak w przypadku naszych ludzkich kompleksów TFIID, nawet ta udana metoda okazała się niewystarczająca". Naukowcy zdali sobie sprawę, że hodowle komórek owadzich zarażonych rekombinowanym bakulowirusem nie były po prostu w stanie wytworzyć TAF w zrównoważony sposób. Niektóre z nich wytwarzały duże, a inne bardzo małe ilości, co prowadziło do nieprawidłowego formowania się kompleksu. Pokonanie tej przeszkody umożliwiła analiza strategii, jaką niektóre wirusy - np. koronawirus - obierają, aby wytworzyć własne białka. W czasie replikacji koronawirus wytwarza bardzo duże poliproteiny, które są następnie dzielone przez wysoce swoistą proteazę na pojedyncze enzymy i czynniki białkowe potrzebne koronawirusowi. "Powstało wiele teorii, które bazując na skąpych danych wyjaśniały, w jaki sposób ten niezbędny kompleks utrzymuje się razem" - wyjaśnia Christoph Bieniossek, autor naczelny raportu z badań. "Nasze analizy wskazują, że zasadniczo żadna z tych teorii nie była poprawna. Sposób składania TAF okazał się znacznie bardziej złożony niż wcześniej przypuszczano". Autorzy opisują, jak ten kompleks rdzenia TFIID, który wedle ich ustaleń cechuje się podwójną symetrią, staje się asymetryczny w czasie powiększania się o przyrastające, kolejne TAF na drodze do kompletnego holo-TFIID. Dwie podjednostki, sprowadzane oddzielnie do jądra, wiążą się dokładnie z podwójną osią w rdzeniu TFIID i doprowadzają do dużych przegrupowań strukturalnych, ale tylko w połowie kompleksu. Dzięki temu prostemu acz zgrabnemu mechanizmowi, dwie połowy kompleksu, które były wcześniej identyczne przyjmują odmienny kształt, a powstała w ten sposób asymetria podlega następnie propagacji do momentu uformowania funkcjonalnego kompleksu holo-TFIID. "To dorobek wielu lat intensywnych prac, którego osiągnięcie było możliwe jedynie dzięki owocnej i pasjonującej współpracy z naszymi kolegami z IGBMC, którzy przodują w badaniach nad ludzkim czynnikiem transkrypcyjnym" - podsumowuje Imre Berger. "Teraz znamy niektóre szczegóły wyglądu rdzenia TFIID i tego co się dzieje, kiedy następuje wiązanie dalszych TAF. Jesteśmy przekonani, że otworzyliśmy drogę do poznania w najbliższej przyszłości architektury całego kompleksu TFIID człowieka, a także innych dużych kompleksów wielobiałkowych w regulacji genów, oraz do wyjaśnienia ich roli w katalizowaniu funkcji biologicznej". W badaniach, których wyniki zostały opublikowane w dzisiejszym wydaniu czasopisma Nature, wzięły udział grupy badawcze Imre'a Bergera i Christiane'a Schaffitzela z EMBL Grenoble oraz grupy badawcze Patricka Schultza i Laszlo Tora z IGBMC w Strasburgu. Platforma technologiczna MultiBac wykorzystana w toku tych prac badawczych jest kamieniem węgielnym projektu ComplexINC realizowanego w ramach 7PR KE.Więcej informacji: EMBL Grenoble http://www.embl-grenoble.fr(odnośnik otworzy się w nowym oknie) Projekt ComplexINC http://complexinc.eu/innovation/(odnośnik otworzy się w nowym oknie)