La décomposition des protéines tau agglutinées pour guérir la maladie d’Alzheimer
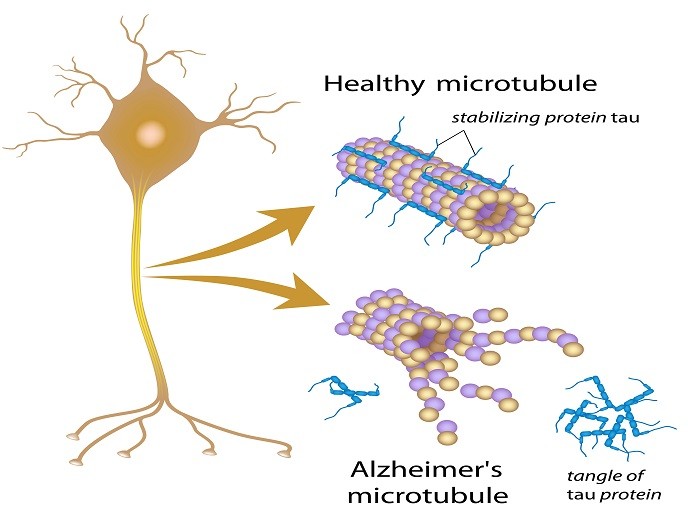
Selon l’Organisation mondiale de la santé, plus de 47 millions de personnes dans le monde sont atteintes de démence, la maladie d’Alzheimer étant la plus répandue (60 à 70 %). Les patients atteints de la maladie d’Alzheimer ont en commun la présence de structures en forme de bâtonnets appelées fibrilles amyloïdes. Composées d’une protéine tau sous sa forme agrégée, elles ont également été impliquées dans un certain nombre d’autres maladies neurodégénératives (tauopathies). Elles incluent la démence frontotemporale, de la paralysie supranucléaire progressive et de la tauopathie primaire liée à l’âge. Dans les neurones sains, la protéine tau stabilise les microtubules qui aident à guider les nutriments du corps du neurone cellulaire vers l’axone et les dendrites. Dans la maladie d’Alzheimer, cependant, des modifications chimiques normales entraîne un détachement de la protéine tau des microtubules et son adhésion à d’autres molécules tau, formant des fils qui finissent par s’enchevêtrer à l’intérieur des neurones. Ces enchevêtrements bloquent le système de transport du neurone, ce qui nuit à la communication synaptique entre neurones. Malgré des efforts de recherche majeurs, le mécanisme d’agrégation de la protéine tau et ses conséquences pathogènes ne sont pas encore compris. Il est urgent de développer des traitements pour guérir ces tauopathies, y compris la maladie d’Alzheimer.
Désenchevêtrer la protéine tau
Saurabh Gautam, boursière de recherche postdoctorante Marie Skłodowska-Curie du REVERSING TAUOPATHY, a décrit les objectifs de l’initiative: «Notre objectif au Max Planck Institute of Biochemistry(s’ouvre dans une nouvelle fenêtre) était de découvrir les conditions de dissolution de ces agrégats de protéines dans le modèle cellulaire humain de "l’agglutinement" ou l’agrégation de la protéine tau.» Le mécanisme et la machinerie cellulaire impliqués dans la dissolution de ces agrégats de tau pourraient entraîner l’élaboration de composés phares pour de nouveaux médicaments. Les travaux préliminaires ont permis d’identifier deux conditions principales lors du désassemblage des agrégats de tau. L’affamement du modèle cellulaire utilisant un milieu dépourvu d’acides aminés – la solution saline équilibrée de Earle – a entraîné la décomposition des agrégats. La désactivation de l’expression de la protéine tau a également provoqué la désagrégation de la protéine indésirable. Les chercheurs ont ensuite utilisé des techniques de pointe telles que le marquage des isotopes stables avec des acides aminés en culture cellulaire – SILAC(s’ouvre dans une nouvelle fenêtre) basé sur la spectrométrie de masse, pour identifier les composants de la machinerie cellulaire impliqués dans la dissolution des agrégats de tau. «Après avoir criblé diverses conditions avec cette méthode populaire de protéomique quantitative, nous avons pu montrer que les agrégats intracellulaires de tau peuvent être désassemblés dans les cellules, ce qui constitue une énorme percée», déclare Saurabh Gautam.
La motivation surmonte les défis techniques
«Ce projet a été difficile dès le début, car il n’y a eu aucun rapport sur la dissolution des agrégats intracellulaires de tau à notre connaissance», explique Saurabh Gautam. «Cependant, l’usage potentiel des résultats et conclusions pour des applications thérapeutiques potentielles nous a incités à travailler dans cette direction», souligne-t-elle. Un autre obstacle majeur a été la reproduction des résultats de l’environnement intracellulaire à l’intérieur d’une éprouvette. Pour ce faire, il a fallu purifier divers composants cellulaires identifiés à l’aide de la technologie de l’ADN recombinant et tenter de dissoudre les agrégats de tau in vitro. «Cela nous permettra d’identifier avec précision les mécanismes et les réactions qui se produisent», explique Saurabh Gautam. Toutefois, les travaux sont toujours en cours. «Chez REVERSING TAUOPATHY, nous estimons que les réponses contribueront à trouver un remède à ces tauopathies», conclut-il.