La modélisation biophysique du transport de membrane cellulaire
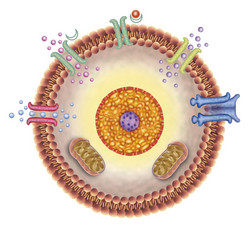
Le projet BIOL-TRANSP-COMPUT (Mechanisms of transport across biological membranes), financé par l'UE, a étudié le complexe complet des fonctions des protéines membranaires. Les chercheurs ont sélectionné trois protéines pour cette étude: la protéine motrice SecA, la pompe à protons de membrane plasmique AHA2 et le canal de cation photosensible. L'objectif était de découvrir les détails de l'association chimio-mécanique et la dynamique de protonation dans le transport en utilisant l'analyse informatique. La base de la recherche BIOL-TRANSP-COMPUT se concentrait sur la liaison de l'hydrogène. La protonation est l'ajout d'un ion d'hydrogène ou d'un proton à une substance, ce qui augmente son acidité. Cette fixation d'hydrogène est essentielle pour que les systèmes de transfert de protons et la conformation des protéines permettent le transport de molécules à travers la membrane cellulaire. La SecA utilise un couplage chimio-mécanique basé sur l'adénosine triphosphate (ATP) pour déplacer des protéines à travers les membranes de bactéries. Dans ce domaine, de nouvelles informations ont été apportées par la bioinformatique, l'analyse de séquences et des calculs sur la dynamique de SecA. Une simulation d'atomes dans l'eau en gros a offert des renseignements importants en dynamique conformationnelle de SecA. Les observations importantes comprennent le couplage des interactions de l'eau et des protéines dans un état de liaison de nucléotides. AHA2, la pompe à protons de la membrane plasmique, appartient à la famille des ATPases de type P. Ces enzymes complexes agissent comme des systèmes de transport secondaires en utilisant le couplage conformationnel à longue distance. L'analyse par le projet a démontré l'accès à l'eau du groupe d'accepteur/donneur de protons primaire et l'interconnexion de la structure et la dynamique avec l'état de protonation. Les channelrhodopsines sont des protéines de transporteurs rétiniens photosensibles. Les chercheurs ont obtenu des informations structurelles sur les variantes de channelrhodopsine par les analyses de séquence et des modèles d'homologie dérivés. Les cycles de réaction des protéines rétiniennes sont lancés par la photo-isomérisation du chromophore rétinien. L'application de mécanique quantique associée et d'une analyse mécanique moléculaire a démontré que la dynamique moléculaire dans les rhodopsines est influencée par les liaisons d'hydrogène avec les groupes de protéines et d'eau environnants. La dynamique des liaisons d'hydrogène est essentielle pour la conformation des transporteurs (ou vecteurs). Les connaissances générales sur les groupes capables de stocker des protons sont nécessaires pour comprendre le mécanisme d'action des systèmes biologiques associés aux protons. Les résultats du projet devraient avoir d'importantes implications sur la conception de médicaments en recherche biomédicale.