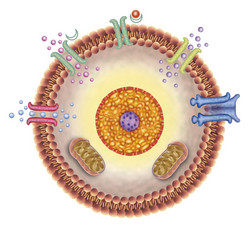
Modelowanie biofizyczne komórkowego transportu błonowego
Uczestnicy finansowanego przez UE projektu (BIOL-TRANSP-COMPUT) (Mechanisms of transport across biological membranes) zbadali cały kompleks funkcji białek błonowych. Naukowcy wybrali do badania trzy białka: białko motoryczne SecA, pompę protonową błony plazmatycznej AHA2 oraz fotoczuły kanał kationowy. Celem było poznanie wpływu chemiczno-mechanicznego sprzężenia i dynamiki protonacji na mediację transportu przy użyciu analizy komputerowej. W projekcie BIOL-TRANSP-COMPUT skoncentrowano się na wiązaniach wodorowych. Protonacja to przyłączenie jonu wodorowego, czyli protonu, do danej substancji, co czyni ją bardziej kwasową. Proces tworzenia wiązania wodorowego jest kluczowy dla układów transportujących protony i konformacji białek, które umożliwiają transport molekuł przez błony komórkowe. Do przenoszenia białek przez błony bakteryjne SecA wykorzystuje zależne od adenozynotrifosforanu (ATP-zależne) sprzężenie chemiczno-mechaniczne. Nowatorską wiedzę z tej dziedziny zapewniły bioinformatyka i analiza sekwencji wraz z wyliczeniami dotyczącymi dynamiki SecA. Symulacja wszystkich atomów w otoczce hydratacyjnej dostarczyła wartościowych informacji o konformacyjnej dynamice SecA. Ważne obserwacje objęły ścisłe sprzężenie oddziaływań białek i wody ze stanem wiązania nukleotydu. Pompa protonowa błony plazmatycznej AHA2 należy do rodziny ATPaz typu P. Dzięki sprzężeniu konformacyjnemu na dużą odległość te skomplikowane enzymy działają jako drugorzędowe systemy transportowe. Analiza przeprowadzona podczas projektu potwierdziła dostęp pierwszorzędowej grupy donora/akceptora protonów do wody oraz wzajemne zależności struktury i dynamiki od stanu protonacji. Rodopsyny kanałowe są wrażliwymi na światło białkami transportowymi siatkówki. Naukowcy uzyskali informacje strukturalne dotyczące wariantów rodopsyny kanałowej poprzez analizy sekwencji i na tej podstawie stworzyli dalsze modele homologiczne. Cykle reakcji białek siatkówkowych są inicjowane poprzez fotoizomeryzację chromoforu siatkówkowego. Kombinowana analiza mechaniki kwantowej/mechaniki molekularnej wykazała, że dynamika molekularna rodopsyn jest kształtowana przez wiązania wodorowe z otaczającymi białkami i cząsteczkami wody. Dynamika wiązań wodorowych jest niezwykle istotna dla konformacji transporterów. Ogólna wiedza na temat grup, które mogą przechowywać protony, jest konieczna do wyjaśnienia mechanizmu działania sprzężonych z protonami systemów biologicznych. Wyniki tego projektu mogą w związku z tym mieć znaczący wpływ na projektowanie leków w ramach badań biomedycznych.