Les métalloenzymes dans le système nerveux
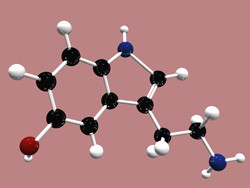
Un tiers des réactions de catalyse enzymatique utilisent le métal comme cofacteur ou incorporé dans la molécule enzymatique. Les métaux, comme le fer, le cuivre, le zinc et le magnésium, participent au transfert électronique et stimulent de nombreuses réactions essentielles. La subvention Marie Curie à financement européen ICSTH («An integrated computational and spectroscopic investigation of the enzyme mechanism of tryptophan hydroxylase«») était consacrée aux métalloenzymes. Au cours du projet, l'attention initiale est passée de la tryptophane hydroxylase, une enzyme impliquée dans la synthèse de la sérotonine, à des enzymes de cuivre binucléaires. La peptidylglycine α-hydroxylante monooxygénase (PAM) et la dopamine β-monooxygénase (DβM) procèdent à la catalyse de l'hydroxylation des substrats qui jouent un rôle crucial dans le fonctionnement du système nerveux. La catalyse dans la PAM et la DβM est lancée par la réduction du cuivre et l'activation de l'oxygène, mais le mécanisme des réactions reste inconnu. Le projet cherchait à comprendre les mécanismes de l'activation de l'oxygène, l'abstraction de l'hydrogène, la liaison avec l'eau et les réactions d'hydroxylation directes catalysées par la PAM et la DβM. La complexité des centres catalytiques du cuivre nécessitait l'utilisation d'une variété de méthodes de chimie computationnelle et de spectroscopie de pointe. La définition de la structure électronique du complexe enzymatique initial supposait déterminer l'état d'oxydation du cuivre et la nature chimique de l'adduit d'oxygène. Dans le cadre de l'analyse du mécanisme d'hydroxylation, les voies de réaction ont été explorées, les états de transition et les intermédiaires de réaction possible de chaque étape améliorés. Des simulations associant la mécanique quantique, moléculaire et dynamique ont permis d'étudier les effets de multiples mutations. Cela a à son tour permis l'exploration des effets conformationnels sur le mécanisme de la réaction. Les résultats de l'ICSTH nous ont permis de mieux comprendre les étapes cruciales du mécanisme d'hydroxylation des enzymes comprenant du dicuivre non couplé. Comprendre cela contribuera à des applications avancées en termes de conception de médicaments, d'ingénierie et de biotechnologie de la protéine.