I metalloenzimi nel sistema nervoso
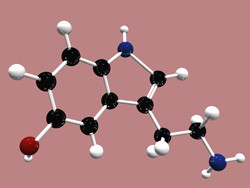
Un terzo delle reazioni di catalisi enzimatica note utilizza i metalli come cofattore oppure incorporati nella molecola dell’enzima. Metalli quali ferro, rame, zinco e magnesio partecipano al trasferimento elettronico e rendono possibili numerose reazioni essenziali. La borsa di ricerca Marie Curie ICSTH (“An integrated computational and spectroscopic investigation of the enzyme mechanism of tryptophan hydroxylase”), finanziata dall’UE, era dedicata ai metalloenzimi. Nel corso del progetto il l’attenzione primaria si è spostata dalla triptofano idrossilasi, un enzima coinvolto nella sintesi della serotonina, agli enzimi binucleari contenenti rame. La peptidilglicina α-monossigenasi (PAM) e la dopamina beta-monoossigenasi (DBM) catalizzano l’idrossilazione di substrati fondamentali per il funzionamento del sistema nervoso. La catalisi in PAM e DβM inizia con la riduzione del rame e l’attivazione dell’ossigeno, ma il meccanismo delle reazioni resta sconosciuto. Il progetto mirava a comprendere i meccanismi dell’attivazione dell’ossigeno, l’astrazione dell’idrogeno, il legame con l’acqua e le reazioni di idrossilazione diretta catalizzate da PAM e DβM. La complessità dei centri di catalisi del rame richiedeva l’impiego di diverse metodologie di ultima generazione in chimica e spettroscopia computazionali. Definire la struttura elettronica del complesso enzimatico iniziale richiedeva la determinazione dello stato di ossidazione del rame e della natura chimica dell’addotto ossigenato. L’analisi del meccanismo di idrossilazione eseguita ha esplorato le vie di reazione, perfezionato gli stati di transizione e i possibili intermedi di reazione di ogni fase. La combinazione di simulazioni di meccanica quantistica, meccanica molecolare e dinamica molecolare ha aiutato a studiare gli effetti di molteplici mutazioni. Ciò ha a sua volta permesso di esplorare gli effetti conformazionali sul meccanismo di reazione. I risultati di ICSTH hanno migliorato la nostra comprensione delle fasi fondamentali del meccanismo di idrossilazione degli enzimi che contengono due atomi di rame non accoppiati. Tale comprensione è necessaria per applicazioni avanzate nella progettazione dei farmaci, nell’ingegneria delle proteine e nelle biotecnologie.