La glycosylation dans l'ostéoporose
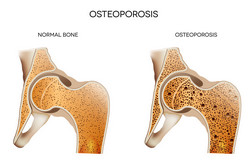
Cette dernière est une maladie associée à l'âge qui concerne la perte de densité osseuse et une réduction de la force qui entraînent une fragilisation des os. Les médicaments actuels peuvent réduire le risque de fractures de 25 à 50 %, nécessitant le besoin de développer de nouveaux médicaments efficaces. Il y a un besoin urgent de définir de nouvelles voies qui contrôlent la remodélisation et la solidité osseuse pour identifier de nouvelles cibles thérapeutiques. Le projet SUGARYBONE (The role of protein N-glycosylation in bone and energy homeostasis), financé par l'UE, a tenté d'étudier les anomalies métaboliques associées à la glycosylation. Plus particulièrement, leurs activités de recherche se sont concentrées sur l'importance de la N-glycosylation des protéines dans l'homéostasie squelettique et son implication dans l'ostéoporose. Les travaux antérieurs ont identifié une mutation dans l'une des enzymes impliquées dans la voie de glycosylation de protéines qui ont provoqué une forte ostéoporose et de l'obésité chez les souris. L'hypothèse était que la N-glycosylation défectueuse perturbait la formation des os par les ostéoblastes, entraînant ainsi de l'ostéoporose, tandis que la réduction des taux d'ostéocalcine dans l'os réduisait la libération d'insuline, favorisant ainsi l'apparition de l'obésité. Les scientifiques de SUGARYBONE ont analysé des souris transgéniques porteuses de la mutation au niveau de l'enzyme Alg13, qui est responsable de l'initiation de la N-glycosylation. Néanmoins, Alg13 a deux isoformes, dont l'un, plus court, englobait l'activité enzymatique et un plus long possédait une fonction inconnue. L'analyse des structures de glycanes des animaux mutants et sauvages n'a montré aucune différence apparente. Aucune altération n'a été observée dans les processus de glycosylation post-traductionnels. L'équipe de recherche a attribué cela au fait que la mutation était dans le long isoforme Alg13, et a donc décidé de générer des lignées de cellules embryonnaires mutantes avec des mutations au niveau de l'isoforme plus court. Bien que les chercheurs emploient différentes stratégies pour perturber l'allèle sauvage Alg13, aucun des clones de cellules embryonnaires porteurs d'une suppression d'Alg13 n'a survécu. Cela a souligné la vitalité de l'enzyme Alg13 dans l'homéostasie de protéines générale et dans la survie des cellules. Néanmoins, les raisons d'étudier le métabolisme des os ostéoporotiques sont scientifiquement valides mais nécessitent une approche investigatrice différente.