Zur Rolle der Glykosylierung bei Osteoporose
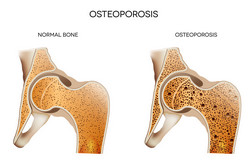
Osteoporose ist eine Alterskrankheit, bei der sich Knochendichte und Festigkeit verringern und die Knochen brüchig werden. Derzeitige medikamentöse Therapien können lediglich das Frakturrisiko um 25 – 50 % senken, sodass neue und wirksamere Medikamente gefragt sind. Dringend benötigt werden neue Strategien, um den Knochenumbau zu steuern und neue therapeutische Zielstrukturen zu finden. Das EU-finanzierte Projekt SUGARYBONE (The role of protein N-glycosylation in bone and energy homeostasis) untersuchte die mit der Glykosylierung assoziierten Stoffwechselstörungen, insbesondere die Rolle der Protein-N-Glykosylierung bei der Knochenhomöostase und deren Beitrag zur Entstehung von Osteoporose. Frühere Arbeiten enthüllten bereits eine Mutation in einem der Enzyme, die am N-Glykosylierungssignalweg beteiligt sind. Diese Mutation führt bei Mäusen zu schwerer Osteoporose und Fettleibigkeit. Die Hypothese lautete, dass eine gestörte N-Glykosylierung die Osteoblastenaktivität und damit die Knochenbildung beeinträchtigt, was den Osteoporoseprozess fördert. Gleichzeitig reduziert sich die Konzentration von Osteocalcin im Knochen, sodass weniger Insulin freigesetzt und Adipositas gefördert wird. SUGARYBONE untersuchte an transgenen Mäusen eine Mutation im Enzym Alg13, das die N-Glykosylierung einleitet. Allerdings existiert Alg13 in zwei Isoformen: einer kurzen Isoform für die enzymatische Aktivität und einer langen mit unbekannter Funktion. Die Analyse der Glykanstrukturen bei Mutanten und Wildtyp ergab keine offensichtlichen Unterschiede, und es wurden keine Veränderungen bei der post-translationalen Glykosylierung beobachtet. Dies lag nach Meinung der Forscher daran, dass die Mutation in der langen Isoform von Alg13 auftrat, sodass anschließend embryonale Zelllinien (ES) mit Mutationen in der kurzen Isoform generiert wurden. Obwohl verschiedene Strategien angewandt wurden, um das Wildtyp-Allel Alg13 funktionsunfähig zu machen, überlebte keiner der ES-Klone mit Alg13-Deletion, was die Bedeutung des Alg13-Enzyms für die gesamte Proteinhomöostase und das Überleben der Zelle verdeutlicht. Die Analyse des Stoffwechsels an osteoporotischen Knochen war aus wissenschaftlicher Sicht zwar sinnvoll, dennoch muss nach einem alternativen Untersuchungsansatz gesucht werden.