Des structures de protéines, transparentes comme le cristal
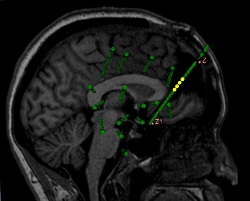
La détermination de la structure des cristaux protéiniques implique la formation de la protéine originale ainsi que d'un dérivé protéinique isomorphe à atome lourd. Ce dérivé présente une structure cristalline identique à celle de la protéine originale, à l'exception de la présence d'atomes lourds liés à des molécules protéiniques. Cette cristallisation est difficile à obtenir et constitue souvent la limitation dans la détermination des structures cristallines. Un nouvel appareil a été développé, pour la formation de dérivés cristallins à l'aide de gaz rares ou toxiques comme le xénon et le krypton. Cet appareil comprend un piston qui amène le gaz utilisé à des pressions allant jusqu'à 100 bar. Une boucle cryo standard sur une broche spéciale est utilisée pour extraire le cristal d'origine de sa protection cryo. Ensuite la broche fixée sur support est clipsée dans l'appareil. Le cristal est ensuite mis sous pression pendant que le dérivé est formé en utilisant les gaz. Le dérivé est ensuite piégé par le froid pour éviter la désorption des gaz liés. De plus, le gaz est entièrement confiné, ce qui permet d'utiliser des gaz très chers sans devoir se réapprovisionner. L'appareil est entièrement automatisé pour faciliter son exploitation. Il permet aussi de reproduire des paramètres déterminant les conditions d'expérimentation comme la pression et la durée d'exposition au gaz du cristal d'origine. Les concepteurs ont développé un prototype de laboratoire et sont à la recherche de partenaires pour la poursuite du développement.