Comprendre la maladie d'Alzheimer
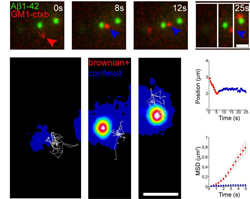
La maladie d'Alzheimer est un trouble neurodégénératif du cerveau associé à une démence clinique. Dans cette maladie, les dépôts observés de protéine bêta-amyloïde sont supposés responsables de la détérioration neuronale. L'influence de la production des peptides bêta-amyloïde sur la diffusion du précurseur de la protéine amyloïde (PPA) reste cependant sujet à controverse. Le projet SINGLEMOLALZHEIMER («Dissecting Alzheimer s disease at a single molecule level»), financé par l'UE, a justement pour objectif l'approfondissement au niveau moléculaire, de notre compréhension de la pathogénèse de cette maladie. Pour ce faire, les partenaires du projet ont utilisé des techniques de suivi moléculaire afin d'étudier l'interaction des polymères bêta-amyloïdes avec les constituants de la membrane cellulaire. Même si cette interaction est déjà correctement établie, les membres du projet ont réussi à décrire la dynamique du comportement de ces agrégats sur la membrane de la cellule. La mobilité de surface des protéines transmembranaires impliquées dans la production des peptides bêta-amyloïde autrement dit PPA, alpha-, bêta- et gamma-secrétase, a ainsi été analysée. Ces expériences démontrent un nouveau mécanisme de toxicité des peptides bêta-amyloïdes provoquée par la diffusion lente des agrégats. Ceux-ci influencent la mobilité et le fonctionnement de constituants membranaires spécifiques provoquant la rupture subséquente de la membrane cellulaire. Un mode d'action similaire a été découvert pour la protéine du diabète de type II amyline, ainsi que pour le prion sup35. Ces données confirment l'hypothèse que toutes les maladies amyloïdes partagent un mécanisme de toxicité similaire. L'extrapolation clinique des travaux du projet SINGLEMOLALZHEIMER est incontestable. Le décryptage du mécanisme de toxicité des peptides bêta-amyloïdes devrait nous permettre de découvrir de nouvelles cibles thérapeutiques pour le traitement de cette maladie débilitante.