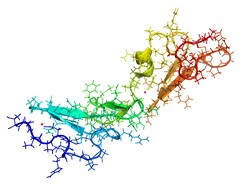
La struttura della proteina e la glicosilazione
La glicosilazione è nota per il suo ruolo nel ripiegamento, nella maturazione, nel traffico e nella secrezione, nonché nella funzione delle proteine. L’aggiunta di un glicano precursore avviene inizialmente nel reticolo endoplasmatico e successivamente nel complesso di Golgi, dove la modificazione matura ulteriormente con l’aggiunta di vare strutture glicemiche. Alla fine, ne deriva una vasta eterogeneità delle catene glicaniche non solo a livello di organismo, cellula e proteina, ma anche al sito di glicosilazione. Oltre alla significatività biologica, l’eterogeneità ha vaste implicazioni per la produzione di composti farmaceutici con una biodiversità glicanica specifica e riproducibile. Comprendendo il ruolo delle diverse catene glicaniche, si potrebbe ridurre l’eterogeneità glicanica di proteine ricombinanti. Per affrontare tale questione, il progetto GLYCAN HETEROGENEITY (Influence of the protein sequence and structure on the glycan micro-heterogeneity), finanziato dall’UE, si è proposto di indagare sul modo con cui l’interazione tra la proteina e il glicano influenza l’eterogeneità dei glicani. Ha studiato un modello di glicoproteina con cinque siti di glicosilazione, mediante approcci classici di biochimica e biologia molecolare, insieme alla spettrometria di massa ad alte prestazioni. Dai risultati è emerso che ciascuno dei cinque siti presentava un profilo glicanico specifico, mentre il sito 4 presentava la minima catena glicanica processata. Gli scienziati hanno stabilito la via seguita con maggiore probabilità per processare ogni sito e hanno calcolato il tasso di conversione enzimatica, identificando potenziali strozzature nel processo. Gli esiti ottenuti indicano che il glicano sul sito 4 interagiva intensamente con un aminoacido specifico presente sulla superficie della proteina e impediva agli enzimi modificanti di accedere al glicano. La mutazione di tale aminoacido ha radicalmente cambiato il profilo in glicani altamente processati, dimostrando la possibilità di modificare il profilo di glicosilazione attraverso una mutazione puntiforme della proteina. Nel complesso, tali risultati evidenziano che la struttura della proteina influenza la processazione dei glicani non solo attraverso impedimento sterico, ma anche attraverso interazione diretta di specifici aminoacidi con la catena glicanica. Se ne deduce che la modificazione della sequenza della proteina potrebbe rappresentare un approccio alternativo per la produzione di glicoproteine ricombinanti a livello industriale.