Struktura białek i glikozylacja
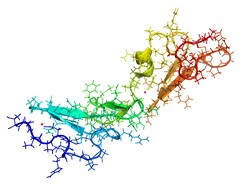
Glikozylacja ma znaną rolę w fałdowaniu, dojrzewaniu, transportowaniu i wydzielaniu białek oraz warunkuje ich funkcje. Dodanie prekursora glikanowego ma miejsce w retikulum endoplazmatycznym, a następnie w aparacie Golgiego, gdzie zmodyfikowane białko ulega dalszemu dojrzewaniu poprzez dodanie różnych motywów cukrowych. Na koniec uzyskuje się ogromną różnorodność struktur glikanowych i miejsca glikozylacji na poziomie organizmu, komórki i białka. Ta różnorodność ma nie tylko znaczenie biologiczne, lecz może też zostać wykorzystana do wytwarzania farmaceutyków o swoistej i odtwarzalnej biozmienności glikanowej. Wyjaśnienie roli różnych struktur glikanowych pomoże ograniczyć heterogenność glikanową białek rekombinowanych. W tym kontekście uczestnicy finansowanego przez UE projektu GLYCAN HETEROGENEITY (Influence of the protein sequence and structure on the glycan micro-heterogeneity) postanowili zbadać, jak interakcje między białkiem a glikanem wpływają na heterogenność tego ostatniego. Analizowali glikoproteiny modelowe o pięciu miejscach glikozylacji korzystając z klasycznych metod biochemii i biologii molekularnej w połączeniu ze spektrometrią mas o dużej wydajności. Wyniki wskazują, że każde z tych pięciu miejsc wiąże się z określonym profilem glikanowym, przy czym w miejscu nr 4 wykryto najmniej przetworzoną strukturę glikanową. Naukowcy określili najbardziej prawdopodobny szlak przetwarzania każdego z miejsc i obliczyli wskaźnik konwersji enzymatycznej, identyfikując potencjalne wąskie gardła procesu. Uzyskane wyniki wskazują, że glikan w miejscu nr 4 silnie oddziałuje ze swoistym aminokwasem na powierzchni białka i uniemożliwia modyfikującym enzymom dotarcie do glikanu. Mutacja tego aminokwasu radykalnie zmienia glikan w silnie przetworzony, co wskazuje na możliwość modyfikowania profilu glikozylacji poprzez mutację punktową w białku. Łącznie wyniki projektu wskazują, że struktura białka wpływa na przetwarzanie glikanów nie tylko poprzez hamujące oddziaływania steryczne, lecz również poprzez bezpośrednie oddziaływanie swoistych aminokwasów ze strukturą glikanową. Modyfikacja sekwencji białka może więc stanowić alternatywną metodę wytwarzania rekombinowanych glikoprotein na poziomie przemysłowym.