Des informations conformationnelles sur les protéines neurotoxiques
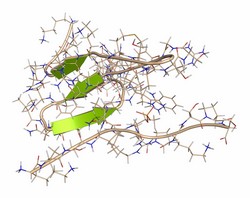
Normalement, dans une conformation désordonnée, certains facteurs de stress facilitent la transition des protéines tau vers un état agrégé. Parmi ceux-ci, on soupçonne que les chaperons moléculaires de la famille des protéines de choc thermique (Hsp) jouent un rôle crucial. L'initiative HSP70-TAU NMR (Structural analysis of the conformational transitions of the K18 fragment of human tau driven by Hsp70 action) a utilisé la spectroscopie à résonance magnétique nucléaire (RMN) pour étudier l'interaction entre Hsp et tau afin d'identifier les facteurs provoquant l'agrégation des protéines. Grâce à des expériences utilisant la RMN et des méthodes biophysiques et biochimiques, les chercheurs ont entièrement caractérisé la liaison du fragment de tau sujet à l'agrégation à deux formes allostériques de Hsp70 Ils ont pu déterminer les régions de tau qui se lient à Hsp70 et Hsp40, et obtenir une meilleure compréhension du complexe ternaire Tau-Hsp40-Hsp70. Ils ont déterminé que différents chaperons Hsp reconnaissent des régions spécifiques de la protéine tau et que cette interaction est essentielle à la régulation de la protéine tau dans la cellule. Pour la première fois, les chercheurs de HSP70-TAU NMR ont élucidé les mécanismes de liaison et d'activation par lesquels les Hsp reconnaissent les modifications structurelles dans les protéines mal repliées. Ces résultats sont très précieux pour concevoir des médicaments ciblant des partenaires de liaison à la protéine tau, en d'autres termes des Hsp, afin de traiter les troubles neurodégénératifs. Étant donné que plus de sept millions de personnes dans l'UE souffrent de protéinopathies amyloïdogènes, les découvertes facilitant le développement de ces médicaments puissants pourraient considérablement alléger le fardeau des maladies neurodégénératives.