Chromatinmodifikation bei Multipler Sklerose
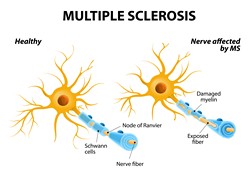
Die Regeneration der axonalen Myelinisierung gilt nun als attraktiver Ansatz zur Behandlung von MS. Das erfordert jedoch ein in die Tiefe gehendes Verständnis des Prozesses und des Beitrags verschiedener Zelltypen. Man nimmt heute an, dass der Zellphänotyp und dessen Schicksal durch den epigenetischen Zustand einer Zelle bestimmt werden, der Histonmodifikationen und DNA-Methylierung beinhaltet sowie Schlüsselprozesse wie etwa die Transkription regelt. Oligodendrozyten (OL) sind Gliazellen, welche die Myelinisierung von Nervenzellen vermitteln und von OL-Vorläufern abgeleitet sind. Die Regulierung der OL-Vorläuferdifferenzierung erfordert die konzertierte Wirkung verschiedener Transkriptionsfaktoren wie beispielsweise Sox2, Sox10 und Sox9. Es ist jedoch unklar, welche transkriptionalen Wirkmechanismen verantwortlich sind, und ob die Differenzierung die Rekrutierung epigenetischer Modulatoren wie etwa chromatinmodifizierender Enzyme beinhaltet. Um hier anzusetzen, nutzten die Wissenschaftler des EU-finanzierten Projekts EPIOPC (Role of chromatin-modifying enzymes in oligodendrocyte precursor state in development and multiple sclerosis) MS-Tiermodelle und untersuchten die Rolle chromatinmodifizierender Enzyme während der OL-Entwicklung. Zudem erkundeten sie die Heterogenität von Zellen der OL-Entwicklungslinien sowie von deren transkriptionellen sowie epigenetischen Zuständen. Die Ergebnisse belegten, dass Isoformen 2 und 3 der Histon-Deacetylase (HDAC) an Gene in neuronalen Stammzellen (NSCs) binden. Histon-Deacetylasen entfernen Acetylgruppen aus Histonproteinen und ermöglichen es ihnen auf diese Weise, die DNA enger zu wickeln, was sie unzugänglich für die Transkription macht. Interessanterweise stellte man fest, dass der Transkriptionsfaktor Sox2 und HDAC2 gleichzeitig an die regulatorischen Regionen von Myelin-verwandten Genen binden. HDAC2 unterdrückte aktiv die OL-Differenzierung von Vorläufern und NSCs durch Hemmung des Transkriptionsfaktors Sox10. Das Konsortium erprobte die Wirkung der HDAC-Hemmung aus einem therapeutischen Blickwinkel. In einem Rattenmodell der experimentellen autoimmunen Enzephalomyelitis verbesserte die Behandlung mit dem HDAC-Inhibitor Valproinsäure und dem Schilddrüsenhormon die Krankheitssymptome. Auf diese Weise wurde das Potenzial dieses Ansatzes für die Behandlung von MS deutlich. Insgesamt konnte das EPIOPC-Projekt einige der wichtigsten molekularen Mechanismen der OL-Differenzierung und Myelinisierung offenlegen. Die identifizierten Chromatinmoleküle könnten als Targets epigenetisch gestützter Therapien bei Demyelinisierungskrankheiten wie beispielsweise MS dienen.