Mettre un frein au virus de la grippe
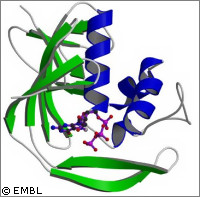
Des scientifiques européens ont éclairci la façon dont le virus de la grippe détournait la machinerie de production cellulaire de son hôte. Leur découverte pourrait mener au développement de nouveaux médicaments permettant de combattre une éventuelle pandémie de grippe. Ces travaux ont été soutenus par le projet FLUPOL, financé par l'UE à hauteur d'environ 1,97 million d'euros. La crainte d'une pandémie de grippe est l'une des plus sérieuses préoccupations des gouvernements et organismes de santé. Ces derniers s'inquiètent de la transmission éventuelle de souches très virulentes de grippe aviaire, telles que H5N1, chez l'homme. En conséquence, de nouveaux traitements et méthodes permettant de stopper la diffusion du virus sont à l'étude. Dans le cadre de cette dernière étude, une équipe de biologie structurelle menée par Stephen Cusack du Laboratoire européen de biologie moléculaire (LEBM) a exploré l'une des méthodes du virus de la grippe pour prendre le contrôle des cellules infectées. Les résultats ont été publiés dans la revue Nature Structural and Molecular Biology. Les chercheurs ont obtenu une image haute résolution d'un domaine protéique clé, dont la fonction est de permettre au virus de se multiplier en détournant le système cellulaire de production de protéines. Dès que le virus de la grippe infecte une cellule, il commence à s'y multiplier. La polymérase virale est une protéine essentielle à ce processus. Cette enzyme recopie le matériel génétique du virus et participe à la fabrication de davantage de virus. L'une de ses sous-unités, la PB2, intervient pour s'approprier un «marqueur» important à partir des molécules d'ARN de la cellule hôte. Ce marqueur sert ensuite à orienter le système de production de protéines vers la synthèse des protéines du virus. Les scientifiques des équipes de recherche de Stephan Cusack et Darren Hart, au LEBM Grenoble, ont découvert sur PB2 la zone responsable de la liaison avec le marqueur. Ils ont produit des cristaux à partir des molécules, qu'ils ont étudiés à l'aide du puissant rayonnement X de l'installation européenne de rayonnement synchrotron (ESRF). «Les virus sont des maîtres de subtilité lorsqu'il s'agit de détourner le fonctionnement normal de la cellule hôte. Le virus de la grippe vole un «mot de passe» aux ARN messagers de l'hôte, des molécules qui transportent les instructions pour la fabrication des protéines; il l'utilise ensuite pour accéder à la machinerie cellulaire de fabrication des protéines et la détourner pour ses besoins propres», déclare le Dr Cusack. Concrètement, ce mot de passe est un petit bout d'ARN, nommé «coiffe» (cap). Cette coiffe doit être présente au début de chaque ARN messager (ARNm) pour orienter le processus de synthèse protéique de la cellule. La polymérase virale s'attache à l'ARNm par la coiffe, la retire et l'ajoute au début de son propre ARNm. Ce processus est nommé «cap snatching» (ou vol de coiffe). Le système de production de protéines de la cellule hôte reconnaît alors l'ARNm viral, avec sa coiffe empruntée, et commence à fabriquer les protéines du virus aux dépens de celles de la cellule. Les chercheurs du LEBM ont obtenu une image montrant la sous-unité PB2 associée à une coiffe, et révélant pour la première fois les acides aminés impliqués dans la reconnaissance de cette structure particulière. Ils ont ainsi pu identifier la coiffe, prise en sandwich entre deux acides aminés de la PB2. Ce mécanisme de reconnaissance diffère peu de celui des autres protéines qui s'associent à la coiffe, mais ses détails structurels sont particuliers. Des collègues du Centro Nacional de Biotecnologia de Madrid (Espagne) ont montré que la perturbation des sites de liaison de la PB2 avec la coiffe arrêtait la multiplication du virus de la grippe. «Ces découvertes suggèrent que le site d'association avec la coiffe, sur la sous-unité PB2, est une cible très prometteuse pour des médicaments contre la grippe», déclare Darren Hart. «Ces nouvelles informations structurelles nous aideront à concevoir des analogues de la coiffe, qui inhiberaient la multiplication du virus et, par conséquent, limiteraient sa propagation ainsi que la gravité de l'infection.»