Une nouvelle approche sur mesure indique une percée dans l’évolution dirigée des enzymes stables
Les enzymes présentes dans la nature pourraient être manipulées pour réaliser de nouvelles prouesses en altérant leur séquence d’ADN. Cette idée, qui a valu à une ingénieure chimiste américaine le prix Nobel de chimie 2018(s’ouvre dans une nouvelle fenêtre), est née de la conception de Darwin sur l’évolution biologique qui combine les processus de mutation et de recombinaison génétiques et la sélection naturelle. Ce processus d’évolution est aujourd’hui de plus en plus utilisé dans les laboratoires de chimie pour créer de nouvelles enzymes: le processus commence par la découverte d’une enzyme favorable qui produit faiblement la réaction désirée, qui est ensuite mutée et testée pour l’activité désirée. Après de nombreux cycles d’optimisation, une enzyme évoluée présentant l’activité désirée émerge. Cette version artificielle et accélérée du processus d’évolution est appelée évolution dirigée. Les enzymes développées par évolution dirigée sont une alternative verte aux métaux toxiques ou aux solvants organiques utilisés en grande quantité. Malgré les progrès réalisés dans ce domaine, l’utilisation des enzymes pour la production de produits chimiques, de matériaux et de médicaments fins n’est pas exploitée à son plein potentiel en raison de leur tolérance limitée aux conditions non physiologiques. Les températures élevées ou les microenvironnements non naturels (tels qu’un pH extrême et la présence de solvants et de détergents organiques) se révèlent souvent inadaptés aux enzymes, fragilisant leur stabilité et donc leur sélectivité et leurs activités.
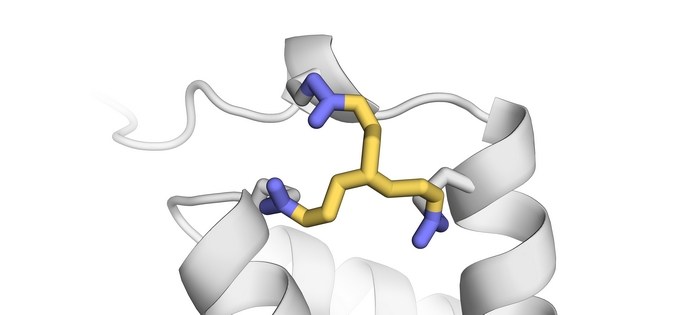
Les protéines circulaires sont plus stables
Des scientifiques européens se sont penchés sur le sujet avec le soutien du Conseil européen de la recherche (CER). Tom Grossmann, professeur de chimie au département de chimie et de sciences pharmaceutiques(s’ouvre dans une nouvelle fenêtre) de l’université d’Amsterdam, et son équipe ont synthétisé et testé des réactifs de réticulation présentant diverses propriétés physiques et chimiques qui se lient à différentes parties des enzymes pour produire des versions résistantes et plus efficaces. Au cœur de leurs travaux se retrouve une toute nouvelle stratégie de stabilisation appelée cyclisation in situ des protéines (INCYPRO). Tom Grossmann explique le principe qui sous-tend ce concept: «INCYPRO permet un processus de conception simple, informatique et non itératif qui implique l’introduction de trois cystéines dans l’enzyme qui réagissent ensuite avec un réticulant électrophile à trois centres.» L’équipe du projet a créé différents réticulants en «décorant» une structure centrale symétrique — triéthylamine, triazinane ou benzène — avec trois électrophiles, à savoir l’acrylamide, le chloroacétamide et le vinylsulfonamide (espèces chimiques qui attirent les électrons). Le réticulant réagit avec les trois chaînes latérales thiol des cystéines sur l’enzyme, ce qui résulte en une protéine multicyclique dont la structure centrale est plus robuste (stable). Plus l’électrophile «aime» les électrons, plus le réticulant se lie rapidement aux groupes thiols.
Une meilleure alternative aux approches de stabilisation existantes
INCYPRO utilise des enzymes entièrement composées d’acides aminés naturels qui peuvent être obtenus rapidement, à moindre coût et en grande quantité. «Les approches actuelles de stabilisation des enzymes nécessitent de nombreux cycles d’optimisation ou impliquent des acides aminés non naturels qui compliquent la production d’enzymes. Cela prolonge la durée du processus de conception et augmente les coûts de production de la nouvelle enzyme», ajoute Tom Grossmann. Qui plus est, une approche existante se concentre sur l’augmentation de la stabilité d’une petite partie d’une protéine. Le professeur et son équipe ont poursuivi les travaux menés dans le cadre d’un autre projet financé par l’UE, PEP-PRO-RNA, également soutenu par le CER. «Dans le cadre du projet PEP-PRO-RNA, nous avons développé des architectures moléculaires (réticulants) pour relier deux ou trois parties différentes d’un fragment de protéine. Nous avons ensuite conçu INCYPRO pour démontrer que ces types de réticulants peuvent également stabiliser la protéine entière», explique Tom Grossmann. Les enzymes robustes et efficaces sont des alternatives viables aux réactifs toxiques utilisés par les industries chimiques et pharmaceutiques; de plus, elles raccourcissent souvent les voies à plusieurs étapes de la synthèse des produits chimiques et des médicaments. «Des approches de stabilisation simples et à haut rendement telles qu’INCYPRO ont un impact positif sur le domaine de la chimie verte», conclut Tom Grossmann.