Nowe spersonalizowane podejście sygnalizuje przełom w ukierunkowanej ewolucji stabilnych enzymów
Występujące w przyrodzie enzymy można dostosowywać tak, aby pełniły one nowe funkcje, poprzez zmianę sekwencji ich DNA. Błyskotliwość tego pomysłu, dzięki któremu amerykańska chemiczka zdobyła w 2018 roku Nagrodę Nobla w dziedzinie chemii(odnośnik otworzy się w nowym oknie), wynikała z koncepcji ewolucji biologicznej Darwina, która łączy w sobie procesy mutacji genetycznej i rekombinacji oraz selekcji naturalnej. Ten proces ewolucji jest obecnie coraz częściej wykorzystywany w laboratoriach chemicznych do tworzenia nowych enzymów: rozpoczyna się on od znalezienia podatnego enzymu, który w słabym stopniu przeprowadza pożądaną reakcję, a następnie poddawany jest mutacji i testom pod kątem pożądanej aktywności. Po wielu cyklach optymalizacyjnych wyłaniany jest wyewoluowany enzym o pożądanej aktywności. Ta sztuczna, przyspieszona wersja procesu ewolucji nazywana jest ewolucją ukierunkowaną. Enzymy opracowane z zastosowaniem ewolucji ukierunkowanej są ekologiczną alternatywą dla stosowania toksycznych metali lub rozpuszczalników organicznych w dużych ilościach. Pomimo dokonanego postępu w tej dziedzinie stosowanie enzymów do produkcji wysokowartościowych chemikaliów, materiałów i leków nie jest w pełni wykorzystywane ze względu na ich ograniczoną tolerancję na warunki niefizjologiczne. Podwyższone temperatury lub nienaturalne mikrośrodowiska (o skrajnych wartościach pH i obecności organicznych rozpuszczalników i detergentów) często okazują się być dla enzymów nieodpowiednie, naruszając ich stabilność, a tym samym selektywność i aktywność.
Białka cyrkularne są bardziej stabilne
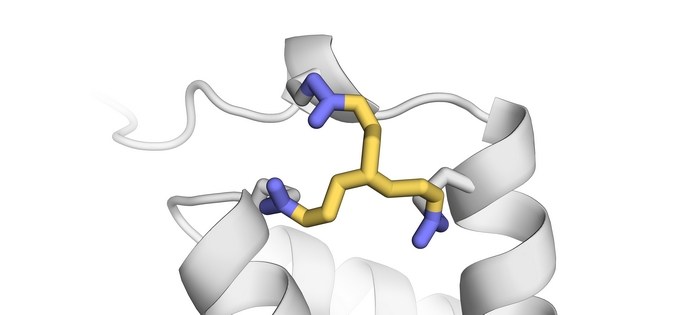
Europejscy naukowcy zajęli się tym zagadnieniem przy wsparciu Europejskiej Rady ds. Badań Naukowych (ERBN). Profesor chemii Tom Grossmann z Wydziału Chemii i Nauk Farmaceutycznych(odnośnik otworzy się w nowym oknie) na Wolnym Uniwersytecie w Amsterdamie wraz ze swoim zespołem dokonali syntezy i przetestowali odczynniki sieciujące o różnych właściwościach fizycznych i chemicznych, które wiążą się z różnymi częściami enzymów, tworząc ich trwałe i bardziej wydajne wersje. U podstaw ich pracy leży całkowicie nowa strategia stabilizacyjna zwana cyklizacją białek in situ (ang. in situ cyclisation of proteins, INCYPRO). Grossmann wyjaśnia zasadę, na której opiera się ta koncepcja: „Strategia INCYPRO umożliwia przeprowadzenie prostego, obliczeniowego i nieiteracyjnego procesu projektowania, który polega na wprowadzeniu do enzymu trzech cystein, które następnie reagują z elektrofilowym środkiem sieciującym z trzema ośrodkami”. Zespół projektu stworzył różne środki sieciujące, „ozdabiając” symetryczną strukturę jądra – trietyloaminę, triazynan lub benzen – trzema elektrofilami – akryloamidem, chloroacetamidem i sulfonamidem winylu (gatunki chemiczne przyciągające elektrony). Środek sieciujący reaguje z enzymem za sprawą trzech tiolowych łańcuchów bocznych cystein, tworząc multicykliczne białko o trwalszej (stabilniejszej) strukturze jądra. Im bardziej elektrofil przyciąga elektrony, tym szybciej wiąże się z grupami tiolowymi.
Lepsza alternatywa dla istniejących podejść stabilizacyjnych
Strategia INCYPRO wykorzystuje enzymy składające się w całości z naturalnych aminokwasów, które mogą być uzyskiwane w szybki i ekonomiczny sposób i w dużych ilościach. „Obecne podejścia do stabilizacji enzymów wymagają przeprowadzenia wielu cykli optymalizacyjnych lub użycia nienaturalnych aminokwasów, które komplikują produkcję enzymów. Przedłuża to proces opracowywania i zwiększa koszty wytworzenia nowego enzymu”, dodaje Grossmann. Co więcej, istniejące podejście skupia się na zwiększeniu stabilności niewielkiej części białka. Profesor wraz ze swoim zespołem kontynuowali prace prowadzone w ramach innego finansowanego ze środków UE projektu, PEP-PRO-RNA, również wspieranego przez ERBN. „W ramach projektu PEP-PRO-RNA opracowaliśmy architektury molekularne (środki sieciujące) łączące dwie lub trzy różne części fragmentu białka. Następnie opracowaliśmy strategię INCYPRO, aby wykazać, że mogą one również posłużyć do stabilizacji całego białka”, zauważa Grossmann. Wytrzymałe i wydajne enzymy są realną alternatywą dla toksycznych odczynników stosowanych w przemyśle chemicznym i farmaceutycznym i często skracają wieloetapowe metody syntezy substancji chemicznych/leków. „Proste i wysokowydajne podejścia stabilizacyjne, takie jak INCYPRO, mają pozytywny wpływ na dziedzinę zielonej chemii”, podsumowuje Grossmann.