Un nuevo enfoque personalizado señala un gran avance en la evolución dirigida de enzimas estables
Las enzimas presentes en la naturaleza podrían modificarse para que lleven a cabo otras funciones por medio de alteraciones en la secuencia de su ADN. La chispa de esta idea, que le valió a un ingeniero químico estadounidense el Premio Nobel de Química en 2018(se abrirá en una nueva ventana), surgió de la concepción sobre la evolución biológica de Darwin, que combina los procesos de mutación y recombinación genética con la selección natural. Este proceso evolutivo se utiliza cada vez más en laboratorios químicos para crear nuevas enzimas: para empezar, se busca una enzima susceptible de ser modificada que efectúe débilmente la reacción deseada y luego se la somete a mutaciones y a pruebas respecto de la actividad deseada. Tras muchos ciclos de optimización, se consigue una enzima evolucionada que ejecuta la actividad deseada. Esta versión artificial y acelerada del proceso de evolución se denomina evolución dirigida. Las enzimas desarrolladas mediante evolución dirigida son una alternativa ecológica a los metales tóxicos y a las grandes cantidades de disolventes orgánicos. A pesar de los progresos realizados en este campo, las enzimas no se aprovechan plenamente para producir sustancias químicas finas, materiales y fármacos debido a su tolerancia limitada a las condiciones no fisiológicas. Las temperaturas elevadas o los microambientes no naturales (como el pH extremo y la presencia de detergentes y disolventes orgánicos) con frecuencia resultan inadecuados para las enzimas y ponen en entredicho su estabilidad y, en consecuencia, su selectividad y actividad.
Las proteínas circulares son más estables
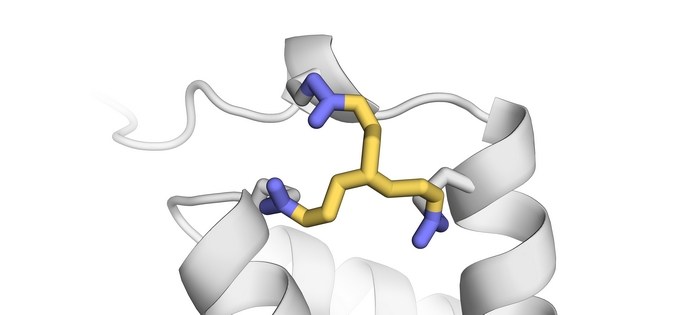
Unos científicos europeos abordaron este tema con el apoyo del Consejo Europeo de Investigación (CEI). Tom Grossmann, catedrático del Departamento de Química y Ciencias Farmacéuticas(se abrirá en una nueva ventana) de la VU de Ámsterdam, y su equipo han sintetizado y probado reactivos de reticulación con diversas propiedades físicas y químicas, que se unen a diferentes partes de las enzimas para producir versiones resistentes y más eficientes. En el centro de su trabajo se halla una estrategia de estabilización completamente nueva llamada ciclización de proteínas «in situ» (INCYPRO). Grossmann explica el principio subyacente de este concepto: «INCYPRO permite seguir un proceso de diseño directo, computacional y no iterativo que implica la introducción en la enzima de tres cisteínas, las cuales reaccionan con un reticulador electrófilo de tres centros». El equipo del proyecto creó diferentes reticuladores a base de «decorar» una estructura central simétrica —trietilamina, triazinano o benceno— con tres electrófilos: acrilamida, cloroacetamida y sulfonamida de vinilo (especies químicas que atraen electrones). El reticulador reacciona con las tres cadenas laterales de tioles presentes en las cisteínas de la enzima, lo que da como resultado una proteína policíclica de estructura central más robusta (estable). Cuanto más «afín a los electrones» sea el electrófilo, más rápido se unirá el reticulador a los grupos de tioles.
Una alternativa mejor a los enfoques de estabilización existentes
INCYPRO utiliza enzimas íntegramente compuestas por aminoácidos naturales que pueden obtenerse de manera rápida, económica y en grandes cantidades. «Los sistemas de estabilización enzimática actuales requieren numerosos ciclos de optimización o incorporan aminoácidos no naturales, lo cual complica la producción de enzimas. Esto prolonga el proceso de diseño y aumenta los costes de producción de la nueva enzima», añade Grossmann. Además, un enfoque existente se centra en aumentar la estabilidad de una pequeña porción de proteína. El catedrático y su equipo continuaron la labor desarrollada por otro proyecto financiado con fondos europeos, PEP-PRO-RNA, también apoyado por el CEI. «En PEP-PRO-RNA, desarrollamos arquitecturas moleculares (reticuladores) para conectar dos o tres partes diferentes de un fragmento de proteína. A continuación, concebimos INCYPRO para demostrar que tales tipos de reticuladores también pueden estabilizar la proteína completa», señala Grossmann. Las enzimas robustas y eficientes son alternativas viables a los reactivos tóxicos utilizados en las industrias química y farmacéutica y, a menudo, acortan los numerosos pasos que conforman las rutas de síntesis de los fármacos y sustancias químicas. «Los enfoques de estabilización directos y de gran eficiencia como INCYPRO repercuten de forma positiva en el campo de la química ecológica», concluye Grossmann.