Neuer gezielter Ansatz ermöglicht Durchbruch in der gerichteten Evolution stabiler Enzyme
Natürlich vorkommende Enzyme könnten durch gezielte Eingriffe in ihre DNS-Sequenz so verändert werden, dass sie neue Aufgaben erfüllen könnten. Diese Idee, die einer amerikanischen Chemieingenieurin den Nobelpreis für Chemie 2018(öffnet in neuem Fenster) einbringen sollte, entstammt ursprünglich Darwins Konzept der biologischen Evolution, das auf genetischer Mutation und Rekombination sowie natürlicher Selektion beruht. Diese Evolutionsprozesses wird in chemischen Laboren mittlerweile zunehmend eingesetzt, um neue Enzyme zu entwickeln. Dabei beginnt man damit, ein geeignetes Enzym zu suchen, das die gewünschte Reaktion in etwa katalysiert. Dieses wird dann mutiert und auf die gewünschte Wirkung getestet. Nach mehreren Optimierungszyklen tritt schließlich ein evolviertes Enzym mit der gewünschten Wirkung hervor. Diese künstliche, beschleunigte Variante des Evolutionsprozesses wird als gerichtete Evolution bezeichnet. Enzyme, die durch gerichtete Evolution entwickelt werden, sind eine grüne Alternative zu toxischen Metallen oder erheblichen Mengen an organischen Lösungsmitteln. Trotz der Fortschritte in diesem Bereich ist es noch nicht gelungen, das volle Potenzial von Enzymen zur Produktion von Feinchemikalien, Materialien und Wirkstoffen auszuschöpfen, da sie gegenüber nichtphysiologischen Bedingungen nur begrenzt tolerant sind. Die erhöhten Temperaturen bzw. die unnatürlichen Mikroumgebungen (z. B. extreme pH-Werte oder das Vorliegen von organischen Lösungsmitteln und Detergenzien) sind für die Enzyme oft ungeeignet, da sie ihre Stabilität und damit auch ihre Selektivität und Wirkung beeinträchtigen.
Zirkuläre Proteine sind stabiler
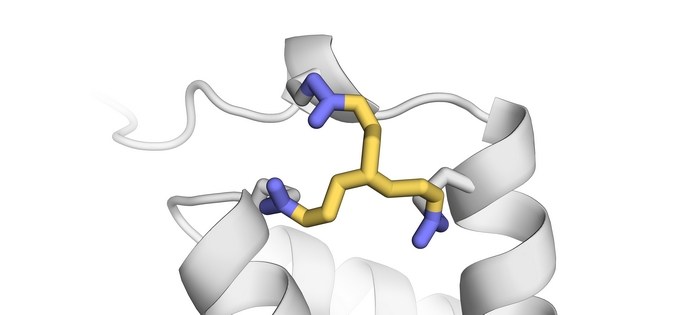
Europäische Forschende haben sich mit Unterstützung des Europäischen Forschungsrates (ERC) dieser Herausforderung gewidmet. Tom Grossmann, Professor für Chemie am Fachbereich Chemie und Pharmazie(öffnet in neuem Fenster) der Vrije Universiteit (VU) Amsterdam, synthetisierte und testete mit seiner Arbeitsgruppe die Quervernetzung von Reagenzien mit diversen physischen und chemischen Eigenschaften, die an unterschiedliche Teile der Enzyme binden, um robustere und effizientere Version davon herzustellen. Im Zentrum ihres Bemühens steht eine völlig Stabilisierungsstrategie – die sogenannte In-situ-Zyklisierung von Proteinen (INCYPRO). Grossmann erklärt das Prinzip dahinter: „INCYPRO ermöglicht einen unkomplizierten, rechnergestützen, nicht-iterativen Designprozess, bei dem drei Cysteine in das Enzym eingebracht werden, die dann mit einer elektrophilen Quervernetzung mit drei Zentren reagieren.“ Die Projektforschenden stellten unterschiedliche Quervernetzungen her. Dazu statteten sie eine symmetrische Grundstruktur (Triethylamin, Triazinan oder Benzol) mit drei Elektrophilen (Acrylamid, Chloracetamid und Vinylsulfonamid – d. h. elektronenanziehenden chemischen Spezies) aus. Die Quervernetzung reagiert mit den drei Thiol-Seitenketten der Cysteine auf dem Enzym. Dadurch entsteht ein multizyklisches Protein mit einem robusteren (d. h. stabileren) Grundgerüst. Je „elektronenliebender“ das Elektrophil war, desto schneller koppelte sich die Quervernetzung an die Thiolgruppen.
Eine bessere Alternative zu bestehenden Stabilisierungsansätzen
INCYPRO verwendet Enzyme, die vollständig aus natürlichen Aminosäuren bestehen und somit schnell, kostengünstig und in großen Mengen verfügbar sind. „Bisherige Ansätze zur Enzymstabilisierung erfordern entweder mehrere Optimierungszyklen oder die Verwendung nicht natürlicher Aminosäuren, die die Enzymproduktion verkomplizieren. Das führt zu einem längeren Designprozess und höheren Produktionskosten für das neue Enzym“, fügt Grossman hinzu. Ein bestehender Ansatz konzentriert sich sogar darauf, die Stabilität eines kleinen Proteinteils zu erhöhen. Professor Grossman und sein Team führten die Arbeit eines anderen EU-finanzierten Projekts fort, das ebenfalls vom ERC gefördert wurde: PEP-PRO-RNA. „Mit PEP-PRO-RNA entwickelten wir Molekülstrukturen [Quervernetzungen], um zwei oder drei unterschiedliche Teile eines Proteinfragments aneinander zu binden. Wir haben dann INCYPRO ins Leben gerufen, um zu zeigen, dass diese Arten von Quervernetzungen sich auch dazu eignen, das gesamte Protein zu stabilisieren“, merkt Grossmann an. Robuste und effiziente Enzyme sind praktikable Alternativen zu toxischen Reagenzien, die im Chemie- und Pharmaziesektor zum Einsatz kommen, und können die mehrstufigen Syntheserouten für Chemikalien und Wirkstoffe oft verkürzen. „Unkomplizierte und hocheffziente Stabilisierungsansätze wie INCYPRO leisten einen positiven Beitrag zum Feld der nachhaltigen Chemie“, so Grossmann abschließend.