Avance del tratamiento de los pacientes con glioma maligno
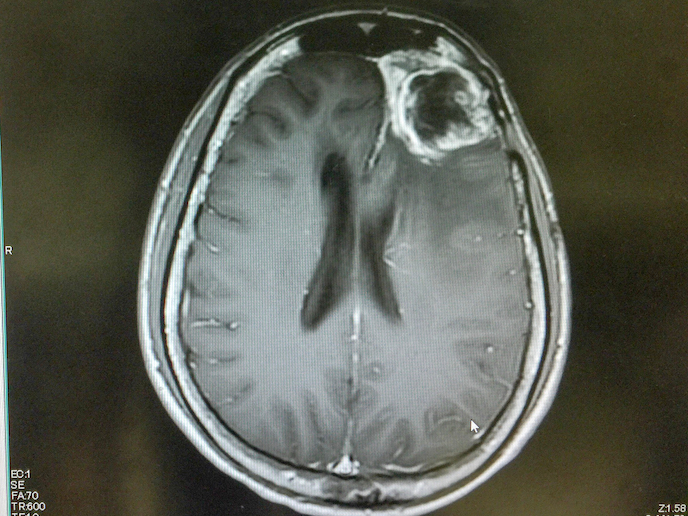
El glioblastoma es un tipo de cáncer encefálico de escasa incidencia y extremadamente agresivo con una tasa de mortalidad muy elevada. De hecho, la duración media de supervivencia de la mayoría de los pacientes que reciben tratamiento es de apenas quince meses. Sin embargo, un nuevo y prometedor compuesto desarrollado por Laminar Pharma(se abrirá en una nueva ventana) denominado LAM561(se abrirá en una nueva ventana) podría ayudar a responder a esta necesidad clínica no cubierta. LAM561 es un lípido bioactivo que se inserta en los lípidos superficiales de las células cancerosas, aumenta la fluidez de la membrana y desprende las proteínas de señalización clave responsables de la propagación del tumor. En consecuencia, el lípido puede entrar en la célula y regular la actividad enzimática, alterando la composición de toda la membrana celular y disolviendo las balsas lipídicas asociadas al cáncer. Con el apoyo del proyecto CLINGLIO(se abrirá en una nueva ventana), financiado con fondos europeos, esta novedosa terapia para tratar a pacientes con glioblastoma recién diagnosticado está un paso más cerca de posiblemente mejorar la calidad y la esperanza de vida de los pacientes.
Desafíos inesperados
El objetivo principal del proyecto era demostrar la seguridad y la eficacia del compuesto LAM561 dentro del procedimiento establecido de atención (radioterapia más temozolomida). Para ello, los investigadores iniciaron un ensayo clínico internacional multicéntrico. El fin de este ensayo era proporcionar la evaluación necesaria para solicitar la aprobación condicional de comercialización a la Agencia Europea de Medicamentos(se abrirá en una nueva ventana) (EMA, por sus siglas en inglés). De hecho, LAM561 podría establecerse en el marco del procedimiento habitual de atención para la enfermedad, si su adición a los tratamientos actuales reduce significativamente el tiempo de progresión del tumor. No obstante, como suele ocurrir con los estudios clínicos complejos, la realización del ensayo resultó más difícil de lo esperado. Por ejemplo, antes de que los investigadores pudieran siquiera empezar, la EMA exigió un ensayo preliminar de fase 1b para confirmar el elevado perfil de seguridad y la dosis más adecuada de LAM561 que debía utilizarse en combinación con radioterapia y temozolomida. Aunque dicho ensayo adicional parecía retrasar el calendario del proyecto, acabó llevando a uno de sus resultados más importantes: la confirmación de la seguridad de LAM561 dentro del procedimiento habitual relativo al tratamiento del glioblastoma.
Al mal tiempo, buena cara
El equipo del proyecto, que está a punto de pasar a la fase II/III de los ensayos clínicos, se encontró de nuevo con un reto inesperado. Esta vez fue la pandemia de COVID-19. Sin embargo, en este caso, los investigadores de CLINGLIO también superaron la adversidad. En concreto, el consorcio(se abrirá en una nueva ventana) se centró en los ámbitos que podía controlar, como la preparación para una posible comercialización y el aumento de la proyección del perfil de LAM561 mediante la publicación de artículos en revistas científicas de alto impacto. El equipo también desarrolló un nuevo formato para el acondicionamiento del medicamento. En lugar de frascos de vidrio, desarrollaron una presentación en sobres que resulta más cómoda, eficiente y sostenible.
Ensayo clínico en curso
Con las restricciones de la COVID-19 levantadas en su mayor parte, Laminar Pharma continúa ahora los estudios clínicos de fase II/III necesarios y espera obtener resultados provisionales sobre la eficacia de LAM561 a finales de 2023. «Nuestra esperanza es que estos ensayos muestren que LAM561 es un método terapéutico con mayor tolerancia y eficacia que los productos disponibles en la actualidad», afirma Victoria Lladó de Laminar Pharma. «Es más, esto no solo sería una gran noticia para una pequeña empresa de biotecnología como Laminar, sino una noticia todavía mejor para los pacientes».