Faire progresser le traitement des patients atteints de gliome malin
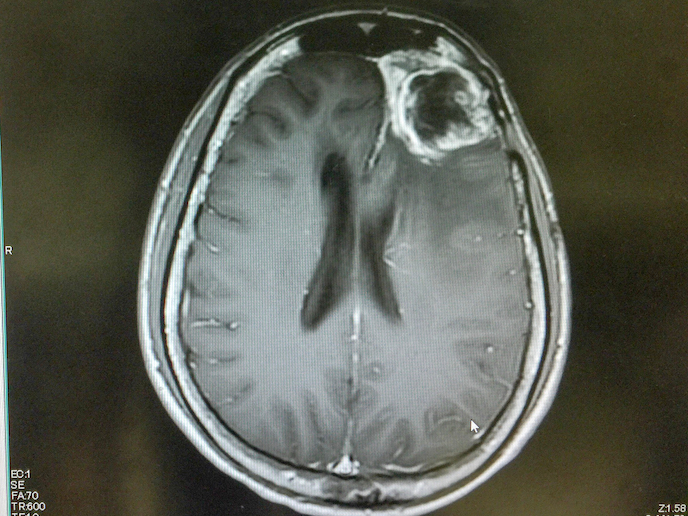
Le glioblastome est un type rare de cancer du cerveau, extrêmement agressif, dont le taux de mortalité est très élevé. La durée moyenne de survie de la plupart des patients traités ne dépasse guère 15 mois. Toutefois, un nouveau composé prometteur développé par Laminar Pharma(s’ouvre dans une nouvelle fenêtre), appelé LAM561(s’ouvre dans une nouvelle fenêtre), pourrait contribuer à remédier à ce triste constat. Le LAM561 est un lipide bioactif qui s’insère dans les lipides de surface des cellules cancéreuses, augmentant la fluidité de la membrane et délogeant les protéines de signalisation clés responsables de la propagation de la tumeur. Le lipide peut ainsi pénétrer dans la cellule et réguler l’activité enzymatique, modifiant la composition de la membrane de la cellule et dissolvant les radeaux lipidiques associés au cancer. Grâce au soutien du projet CLINGLIO(s’ouvre dans une nouvelle fenêtre) financé par l’UE, cette nouvelle thérapie destinée à traiter les patients atteints d’un glioblastome récemment diagnostiqué constitue un pas de plus vers une possible amélioration de la qualité de vie et de l’espérance de vie des patients.
Des défis inattendus
L’objectif principal du projet était de démontrer la sécurité et l’efficacité du composé LAM561 dans le cadre de la norme de soins établie (radiothérapie plus témozolomide). Pour ce faire, les chercheurs ont initié un essai clinique international multicentrique. L’objectif de cet essai était de fournir l’évaluation nécessaire pour demander une autorisation à la demande d’autorisation conditionnelle auprès de l’Agence européenne des médicaments EMA(s’ouvre dans une nouvelle fenêtre). En effet, le LAM561 pourrait être intégré dans la norme de soins pour la maladie si son ajout aux traitements actuels réduit de manière sensible le délai de progression de la tumeur. Mais, comme c’est souvent le cas avec les études cliniques complexes, la conduite de l’essai s’est avérée plus difficile que prévu. Par exemple, avant même que les chercheurs puissent commencer, l’EMA a exigé un essai préliminaire de phase 1b pour confirmer le haut profil de sécurité et la dose la plus appropriée de LAM561 à utiliser en combinaison avec la radiothérapie et le témozolomide. Bien que cet essai supplémentaire ait quelque peu retardé le calendrier du projet, il a finalement abouti à l’un de ses résultats les plus importants: la confirmation de l’innocuité du LAM561 dans le cadre de la norme de soins du glioblastome.
Rester positif
Lorsqu’il fut prêt à passer aux essais cliniques de phase II/III, le projet a de nouveau été confronté à un défi inattendu. Cette fois, il s’agissait de la pandémie de COVID-19. Mais là encore, les chercheurs de CLINGLIO ne se sont pas découragés. Plus précisément, le consortium https://clinglio.eu/consortium.php(s’ouvre dans une nouvelle fenêtre) s’est concentré sur les domaines qu’il pouvait contrôler, comme la préparation d’une éventuelle commercialisation et l’amélioration du profil du LAM561 par la publication d’articles dans des revues scientifiques à fort impact. L’équipe a également mis au point un nouveau format de conditionnement du médicament. Au lieu de bouteilles en verre, ils ont conçu une présentation en sachet plus pratique, plus efficace et plus durable.
L’essai clinique est en cours
Les restrictions imposées par la COVID étant en grande partie levées, Laminar Pharma poursuit maintenant les études cliniques de phase II/III nécessaires, les résultats intermédiaires concernant l’efficacité du LAM561 étant attendus fin 2023. «Nous espérons que ces essais prouveront que le LAM561 est une approche thérapeutique mieux tolérée et plus efficace que ce qui est actuellement disponible», déclare Victoria Llado de Laminar Pharma. «Cela constituerait non seulement une excellente nouvelle pour une petite société de biotechnologie comme Laminar, mais surtout, une nouvelle encore bien meilleure pour les patients».