Fare progredire il trattamento per pazienti affetti da glioma maligno
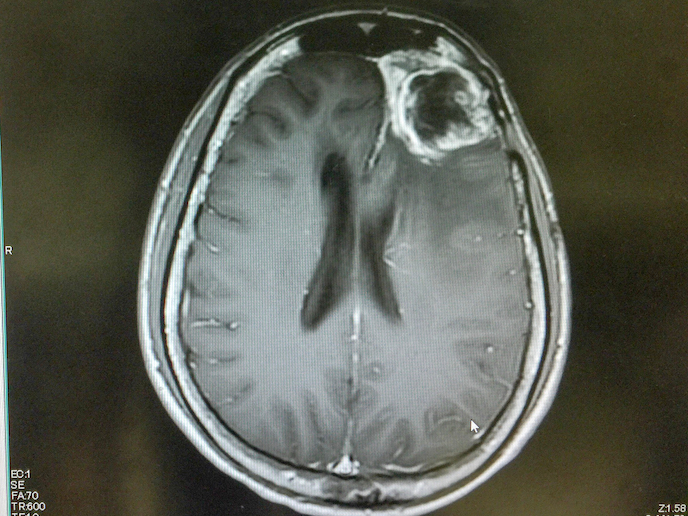
Il glioblastoma è un tipo raro ed estremamente aggressivo di tumore al cervello responsabile di un tasso elevato di mortalità. Infatti, la durata media di sopravvivenza della gran parte dei pazienti in cura equivale ad appena 15 mesi. Malgrado ciò, un nuovo composto promettente sviluppato dall’azienda Laminar Pharma(si apre in una nuova finestra), denominato LAM561(si apre in una nuova finestra) potrebbe contribuire a intervenire su questa esigenza clinica non soddisfatta. LAM561 è un lipide bioattivo che, inserito nei lipidi superficiali delle cellule tumorali, aumenta la fluidità della membrana, spostando così le proteine di segnalazione principali che diffondono il tumore. Di conseguenza, il lipide può introdursi nella cellula e regolare l’attività enzimatica, alterando l’intera composizione della membrana cellulare e dissolvendo le zattere lipidiche associate al tumore. Grazie al sostegno del progetto CLINGLIO(si apre in una nuova finestra), finanziato dall’UE, questa terapia innovativa per il trattamento dei pazienti appena diagnosticati ha compiuto un passo in avanti per quanto riguarda il potenziale miglioramento della qualità e dell’aspettativa di vita dei pazienti.
Sfide impreviste
L’obiettivo principale del progetto riguardava la dimostrazione della sicurezza e dell’efficacia del composto LAM561 nell’ambito di uno standard di cura stabilito, ossia costituito dalla combinazione di radioterapia e temozolomide. Per raggiungere questo traguardo, i ricercatori hanno dato il via a una sperimentazione clinica multicentrica e internazionale. Lo scopo di questa sperimentazione era fornire la valutazione necessaria alla candidatura per l’approvazione in commercio condizionata da parte dell’Agenzia europea per i medicinali(si apre in una nuova finestra) (EMA). In effetti, LAM561 potrebbe essere stabilito come una parte dello standard di cura per la malattia se la sua integrazione nei trattamenti attuali accorcia in maniera notevole il tempo di progressione del tumore. Tuttavia, come accade spesso nel caso di studi clinici complessi, lo svolgimento della sperimentazione si è rivelato più impegnativo del previsto. Ad esempio, prima che i ricercatori potessero effettivamente iniziare, l’EMA ha richiesto loro una sperimentazione di fase preliminare 1b a conferma del profilo di sicurezza elevata e della dose più appropriata di LAM561 da utilizzare insieme a radioterapia e temozolomide. Sebbene questa sperimentazione aggiuntiva sembrasse ritardare la tabella di marcia del progetto, alla fine è sfociata in uno dei suoi esiti più importanti: la conferma della sicurezza di LAM561 secondo lo standard di cura per il glioblastoma.
Fare buon viso a cattiva sorte
Una volta pronto per passare agli studi clinici di fase II/III, il progetto si è trovato dinanzi a un’altra sfida inaspettata, e stavolta si trattava della pandemia di COVID-19. Eppure, anche in questa circostanza, i ricercatori del progetto CLINGLIO, hanno fatto buon viso a cattiva sorte. In particolare, il consorzio(si apre in una nuova finestra) si è concentrato sugli ambiti che erano in grado di controllare, come ad esempio, prepararsi a un’eventuale commercializzazione e innalzare il livello del profilo di LAM561 pubblicando articoli in riviste scientifiche di spicco. Il gruppo ha inoltre realizzato un nuovo formato per il confezionamento del farmaco: anziché utilizzare flaconi di vetro, hanno realizzato una bustina che è più pratica, efficiente e sostenibile.
La sperimentazione clinica è ora in corso
Alla luce della revoca delle restrizioni dovute alla COVID-19, Laminar Pharma sta attualmente proseguendo gli studi clinici di fase II/III necessari, prevedendo di ottenere i risultati intermedi sull’efficacia di LAM561 alla fine del 2023. «La nostra speranza è che queste sperimentazioni dimostrino che LAM561 rappresenti un approccio terapeutico caratterizzato da una migliore tollerabilità ed efficacia rispetto alle terapie al momento disponibili», afferma Victoria Llado di Laminar Pharma. «Sarebbe una notizia positiva non solo per una piccola azienda di biotecnologie come Laminar, ma aspetto più importante, sarebbe ancora più positiva per i pazienti.»