Complejos proteicos, cromatina y enfermedad
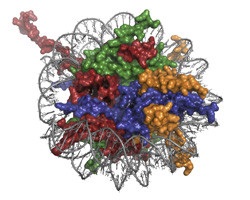
La cromatina, un complejo macromolecular de ADN y proteínas, participa en la regulación de procesos del metabolismo del ADN como la replicación, la transcripción y la reparación. Estos procesos están controlados por complejos proteicos que interactúan con los nucleosomas, las subunidades estructurales de la cromatina. Con el objetivo de estudiar en detalle este complejo proteico de regulación, se inició el proyecto financiado por la Unión Europea MSL1-MSL3-MOF. La proteína MOF se trata de una acetil transferasa que participa en la transcripción del ADN. Las otras dos proteínas presentes en el complejo (la MSL1 y la MSL3) mejoran la actividad enzimática de la proteína MOF. Sin embargo, se desconocen los detalles precisos de la interacción de los componentes de este complejo entre sí y con la cromatina, una laguna en el cocimiento que las actividades del proyecto MSL1-MSL3-MOF se proponen remediar. Los investigadores reconstituyeron, purificaron y caracterizaron bioquímicamente el complejo proteico y mapearon las interacciones entre los componentes del complejo con el fin de definir su actividad catalítica. El equipo de investigación llevó a cabo una reconstrucción tridimensional preliminar del complejo de regulación y diseñaron y probaron un protocolo para el ensamblaje y la purificación del sustrato de cromatina. Antes de aplicar la técnica de cristalografía de rayos X al complejo MSL1-MSL3-MOF, fue necesario definir las condiciones óptimas necesarias para la cristalización y para el análisis estructural empleando un sistema modelo. La cristalografía de rayos X de grandes complejos ADN-proteína supone un gran desafío, por tanto, para definir las condiciones óptimas para su realización, se empleó una proteína de unión a nucleosomas muy bien caracterizada que presenta un bromodominio adyacente (BAH). Se logró determinar con éxito la estructura del BAH y esto puso de manifiesto un cambio conformacional inducido por la acetilación del N-terminal, que es una modificación transcripcional común en eucariotas. El cambio conformacional encontrado posicionaba el BAH acetilado más cerca del nucleosoma en comparación con el BAH no acetilado. Este resultado sugiere un papel general de la N-acetilación en las interacciones entre proteínas. Por tanto, el empleo de este sistema modelo permitió no solo definir las condiciones óptimas necesarias para la aplicación de la cristalografía de rayos X en el complejo MOF, sino que también reveló nueva información estructural. Ya que muchos complejos proteicos implicados en la regulación de la cromatina están vinculados con patologías, la determinación de su estructura permitirá diseñar fármacos específicos para hacer frente a este problema. El trabajo desarrollado en el marco del proyecto MSL1-MSL3-MOF constituyó un primer paso en aras de lograr este importante objetivo.