Complessi proteici, cromatina e malattie
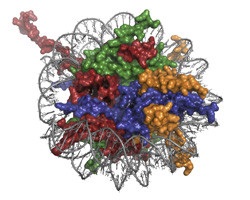
La cromatina è un complesso macromolecolare DNA-proteina che contribuisce alla regolazione dei processi del metabolismo del DNA come replicazione, trascrizione e riparazione. Questi processi sono controllati da complessi proteici che interagiscono con i nucleosomi, le sottounità strutturali della cromatina, uno dei quali è stato studiato nel corso della ricerca condotta dal progetto MSL1-MSL3-MOF. La proteina MOF è un acetiltrasferasi che partecipa alla trascrizione del DNA. Le altre due proteine del complesso (MSL1 e MSL3) potenziano l'attività enzimatica del MOF. I dettagli dell'interazione dei componenti di questo complesso tra loro e con la cromatina sono ancora sconosciuti e hanno fatto l'oggetto degli approfondimenti condotti da questo progetto. I ricercatori hanno ricostituito, purificato e caratterizzato biochimicamente il complesso proteico, mappando le interazioni tra i suoi componenti per definirne l'attività catalitica. Hanno inoltre eseguito una ricostruzione preliminare 3D del complesso regolatore, progettando e testando un protocollo per l'assemblaggio e la purificazione del substrato di cromatina. Prima di procedere con la cristallografia a raggi X dell'MSL1-MSL3-MOF, era necessario definire le condizioni per la cristallizzazione e l'analisi strutturale utilizzando un sistema modello. Poiché la cristallografia di complessi DNA-proteina di grandi dimensioni è piuttosto complessa, per definire le condizioni appropriate si è fatto ricorso a una proteina nucleosoma-legante ben caratterizzata, il dominio BAH (Bromo-adjacent homology, Omologia bromo-adiacente). La struttura BAH è stata risolta e ha rivelato un cambiamento conformazionale indotto dall'acetilazione dell'N-terminale, una modifica post-traslazionale comune negli eucarioti. Questa modifica conformazionale posiziona il BAH acetilato più vicino al nucleosoma rispetto al BAH non acetilato, un risultato che suggerisce un ruolo generale dell'acetilazione N nelle interazioni tra le proteine. L'uso di questo sistema modello ha permesso non solo di definire le condizioni della cristallografia a raggi X del complesso MOF ma anche di chiarire nuove informazioni strutturali. Poiché molti complessi proteici che regolano la cromatina sono collegati alla malattia, la risoluzione della loro struttura permetterà di studiare farmaci specificamente rivolti alla risoluzione del problema. Il lavoro condotto da questo progetto rappresenta un primo passo verso questo importante obiettivo.