Kompleksy białkowe, chromatyna i choroby
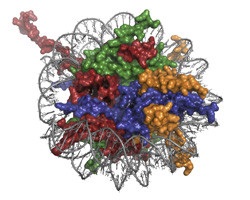
Chromatyna jest makromolekularnym kompleksem DNA i białek, który uczestniczy w regulacji procesów związanych z metabolizmem DNA, takich jak replikacja, transkrypcja i naprawa. Procesy te kontrolowane są przez kompleksy białkowe, które oddziałują z nukleosomami — strukturalnymi podjednostkami chromatyny. Projekt MSL1-MSL3-MOF poświęcony jest badaniom nad jednym z takich kompleksów regulatorowych. Białko MOF jest acetylotransferazą uczestniczącą w transkrypcji DNA. Pozostałe dwa białka w badanym kompleksie (MSL1 i MSL3) wzmagają aktywność enzymatyczną MOF. Szczegóły wzajemnych interakcji między składowymi tego kompleksu oraz ich reakcji z chromatyną są nieznane. Niniejsze badania podjęto w nadziei na uzupełnienie tej luki. Badacze odtworzyli, oczyścili i biochemicznie scharakteryzowali badany kompleks białkowy, a następnie zmapowali interakcje między jego składowymi w celu określenia jego aktywności katalitycznej. Zespół badawczy podjął próbę wstępnej trójwymiarowej rekonstrukcji tego kompleksu oraz zaprojektował i przetestował protokół składania i oczyszczania substratu chromatynowego. Przed przeprowadzeniem rentgenografii strukturalnej kompleksu MSL1-MSL3-MOF konieczne było określenie warunków krystalizacji oraz przeprowadzenie analizy strukturalnej z użyciem systemu modelowego. Ponieważ krystalografia dużych kompleksów DNA i białek jest bardzo wymagająca, w celu określenia odpowiednich warunków dla tego procesu zastosowano dobrze scharakteryzowane białko wiążące nukleosom (odcinek homologiczny do bromodomeny (BAH)). Struktura BAH została z powodzeniem zbadana, dzięki czemu ujawniona została zmiana konformacji wywołana acetylacją N-terminalnego końca białka, co jest powszechną modyfikacją post-translacyjną u eukariotów. Odkryta zmiana konformacyjna umiejscowiła acetylowany BAH bliżej nukleosomu w porównaniu z umiejscowieniem nieacetylowanego BAH. Wynik ten sugeruje ogólną rolę N-acetylacji w interakcjach białek. Tym samym, zastosowanie tego systemu modelowania pozwoliło nie tylko na określenie warunków dla rentgenografii strukturalnej kompleksu MOF, ale także na pozyskanie nowych informacji o strukturze białek. Ponieważ wiele kompleksów regulujących chromatynę związanych jest z chorobami, rozpoznanie ich struktur umożliwi projektowanie specyficznych leków w odpowiedzi na ten problem. Prace poczynione w ramach tego projektu stanowią pierwszy krok ku temu szczytnemu celowi.