Le mauvais repliement de la protéine dans la neurodégénérescence
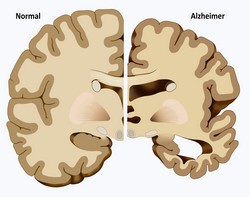
L'agrégation des protéines est une caractéristique de nombreuses maladies neurodégénératives dont la maladie d'Alzheimer, la maladie de Parkinson et les maladies polyglutamines (polyQ). À ce jour, il n'y a aucun traitement causal disponible pour les troubles polyQ, ce qui nécessite le développement urgent de nouvelles stratégies thérapeutiques. Le réseau TREATPOLYQ(s’ouvre dans une nouvelle fenêtre) (TreatPolyQ – Industrial academic initial training network towards treatment of polyglutamine diseases), financé par l'UE, a étudié plusieurs mécanismes importants associés à la maladie et les a traduits en stratégies thérapeutiques prometteuses. Les travaux ont porté sur les deux maladies polyQ les plus courantes, la maladie de Huntington (MH) et l'ataxie spinocérébelleuse de type 3 (SCA3). Les scientifiques ont observé que la localisation nucléaire de l'enzyme de désubiquitination ataxine 3 revêt une importance capitale dans la pathogenèse des maladies polyQ et constitue un objectif prometteur pour les interventions pharmaceutiques. Les protéines de transport impliquées dans la formation des agrégats intranucléaires pourraient être modulées pour alléger le phénotype des mutations d'ataxine 3. Dans des conditions physiologiques, la huntingtine (HTT) influence le transport vésiculaire des facteurs neurotrophiques via la phosphorylation mais dans la HD, cette fonction est perturbée et conduit à la mort neuronale. Les chercheurs de TREATPOLYQ ont étudié le rôle de la protéine HTT en mettant l'accent sur ses conformations et l'interaction avec des complexes de protéines. Pour mieux comprendre le mécanisme de l'ubiquitination dans les troubles neurodégénératifs, les chercheurs ont étudié les mécanismes par lesquels les protéines contenant des polyQ sont dégradées. Comme la macroautophagie est la seule voie capable de dégrader des agrégats de protéines, ils ont étudié ce processus in vitro pour découvrir des peptides capables d'interférer avec la formation de fibrilles HTT. Leurs résultats ont clairement indiqué que les déficits de la dégradation protéasomale associés à la pathologie HD pourraient être évités par une régulation spécifique des cellules de l'autophagie. D'un point de vue de diagnostic, les équipes de recherche ont mis au point de nouveaux tests pour détecter les différentes formes de HTT et identifié les enzymes responsables du maintien de l'étiquetage correct des HTT et de l'ataxine 3 pour la dégradation. Même si davantage de preuves de capacité de modification de la maladie de ces enzymes sont requises, les inhibiteurs d'enzymes pourraient servir de traitement potentiel pour la HD et la SCA3. Dans l'ensemble, le consortium TREATPOLYQ a réussi à décrypter les mécanismes importants liés aux maladies polyQ et a amélioré notre compréhension de l'étiologie de la maladie. D'un point de vue thérapeutique, les résultats du projet influenceront assurément l'issue clinique des patients HD et SCA3 à l'avenir à travers de nouvelles approches thérapeutiques.