Proteinfehlfaltung bei Neurodegeneration
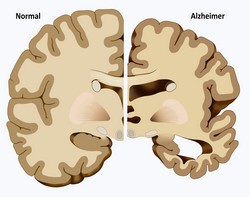
Proteinaggregation ist ein Kennzeichen vieler neurodegenerativer Erkrankungen einschließlich Alzheimer-Krankheit, Parkinson-Krankheit und Polyglutamin-Krankheiten (polyQ). Bis heute gibt es keine kausale Therapie für polyQ -Störungen, weshalb die Entwicklung neuer therapeutischer Strategien dringend erforderlich ist. Das EU-geförderte Netzwerk TREATPOLYQ(öffnet in neuem Fenster) (TreatPolyQ – Industrial academic initial training network towards treatment of polyglutamine diseases) hat sich aufgemacht, ein mehrere wichtige krankheitsassoziierte Mechanismen zu untersuchen und sie in vielversprechende Behandlungsstrategien umzusetzen. Die Arbeit konzentrierte sich auf die beiden häufigsten polyQ-Erkrankungen, Huntington-Krankheit (HD) und spinozerebelläre Ataxie Typ 3 (SCA3). Forscher beobachteten, dass die Kernlokalisation des de-ubiquitinierenden Enzyms Ataxin 3 von entscheidender Bedeutung für die Pathogenese von polyQ-Krankheiten und ein vielversprechendes Ziel für pharmazeutische Interventionen war. Transportproteine, die an der Bildung der intranuklearen Aggregate beteiligt sind, könnten moduliert werden, um den Phänotyp von Ataxin 3-Mutationen zu lindern. Unter physiologischen Bedingungen beeinflusst Huntingtin (HTT) den vesikulären Transport von neurotrophen Faktoren durch Phosphorylierung aber bei HD wird diese Funktion gestört und führt zu neuronalem Tod. Die Forscher von TREATPOLYQ untersuchten die Rolle des HTT-Proteins, indem sie sich auf seine Konformationen und Interaktion mit Proteinkomplexen konzentrierten. Um den Mechanismus der Ubiquitinierung in neurodegenerativen Erkrankungen zu begreifen, untersuchten die Forscher die Mechanismen, mit denen polyQ-haltige Proteine abgebaut werden. Da Makroautophagie der einzige Weg ist, der Proteinaggregate abbauen kann, studierten sie diesen Prozess in vitro, um Peptide zu entdecken, die die HTT-Fibrillenbildung stören können. Ihre Ergebnisse zeigten deutlich, dass die Defizite im proteasomalen Abbau, der mit HD-Pathologie assoziiert ist, durch eine zellspezifische Hochregulierung der Autophagie hätte verhindert werden können. Aus einer Diagnostikperspektive heraus entwickelten die Forscherteams neue Assays, um die verschiedenen HTT-Formen zu erkennen und identifizierten Enzyme, die für die Beibehaltung der korrekten Kennzeichnung von HTT und Ataxin 3 für den Abbau zuständig sind. Obwohl ein weiterer Beweis für die Krankheit modifizierende Fähigkeit dieser Enzyme erforderlich ist, könnten Enzyminhibitoren als potenzielle Behandlung für HD und SCA3 dienen. Insgesamt gelang es dem TREATPOLYQ-Konsortium, wichtige Mechanismen im Zusammenhang mit polyQ-Krankheiten zu entziffern und unser Verständnis der Krankheitsätiologie zu erweitern Aus therapeutischer Sicht werden die Erkenntnisse des Projekts das klinische Ergebnis von HD- und SCA3 -Patienten in der Zukunft durch neue Behandlungsansätze zweifelsfrei beeinflussen.