Aperçu du rôle des écosystèmes bactériens dans le fléau du développement de la résistance aux antibiotiques
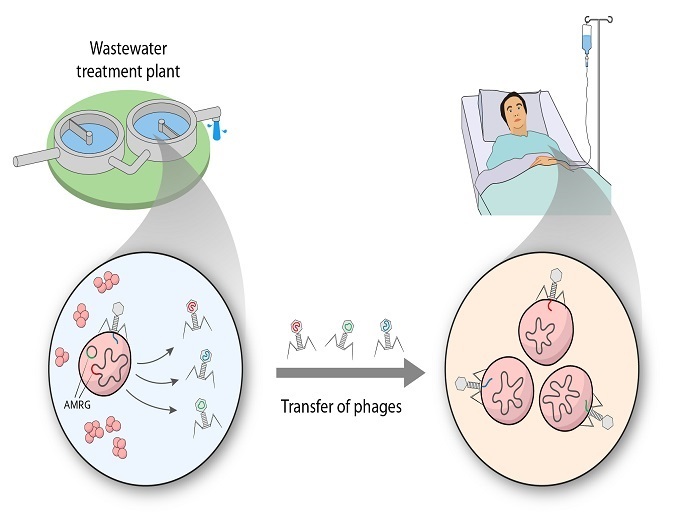
Les bactériophages sont les organismes les plus abondants sur Terre et jouent un rôle central dans la physiologie microbienne et l’homéostasie des écosystèmes. Ils sont spécifiques aux espèces et n’impactent pas la flore commensale humaine, telle que les bactéries intestinales, ce qui en fait une alternative prometteuse aux antibiotiques pour tuer les bactéries pathogènes. De récentes données révèlent toutefois que les phages pourraient interagir avec un éventail plus vaste d’hôtes que ce que l’on pensait, et des preuves indirectes suggèrent que les bactériophages pourraient être impliqués dans la transmission des gènes de RAM.
Étude des bactériophages dans des environnements affectés par l’homme
Le projet ROPHARE a été entrepris avec le soutien du programme Marie Skłodowska-Curie (MSC) et il entendait étudier l’implication des bactériophages dans le transfert horizontal des gènes de RAM parmi les bactéries. Des chercheurs sont partis de la théorie selon laquelle la croissance mondiale de la RAM ne peut s’expliquer exclusivement sur la base de prescriptions inadéquates d’antibiotiques. «Il existe un consensus croissant sur le fait que les communautés microbiennes, les antibiotiques et les gènes de RAM issus d’écosystèmes différents coopèrent afin de diffuser les gènes de RAM et de propager la résistance», explique Elena Gómez-Sanz, titulaire d’une bourse de recherche MSC. Afin d’étudier cette interaction complexe, les chercheurs ont étudié deux systèmes environnementaux gérés par l’homme, à savoir le sol agricole et une station d’épuration des eaux usées. Ils ont isolé et caractérisé environ 100 nouveaux bactériophages staphylococciques dans les eaux de la station d’épuration des eaux usées (non traitées et traitées) et extrait le matériel génétique des communautés microbiennes issues du sol agricole. Cela leur a permis de lever le voile sur des centaines de nouveaux bactériophages environnementaux et de déterminer si les bactériophages transportent les gènes de RAM et comment ils influencent leur propagation vers la communauté entière. Les résultats ont également permis de révéler que plusieurs souches staphylococciques peuvent transférer, bien qu’à une faible vitesse, des gènes de résistance spécifiques à des espèces pertinentes sur le plan clinique, ce qui souligne l’importance du réseau des bactéries et des bactériophages staphylococciques. Ce processus s’est effectué par les plasmides, de petits morceaux circulaires d’ADN distincts du chromosome bactérien principal. À la suite du séquençage et d’une analyse bio‑informatique extensive, les scientifiques ont identifié un nombre inédit de nouveaux bactériophages et de nouveaux gènes de RAM. La plupart des bactériophages identifiés interagissaient avec un vaste éventail d’hôtes, capables d’infecter des souches multirésistantes et pertinentes sur le plan clinique, et certains transportaient les gènes de RAM qui présentaient un intérêt clinique. L’annotation des gènes de RAM récemment identifiés permettra de faire avancer les connaissances actuelles sur la génétique de la résistance.
Portée du projet ROPHARE et perspectives d’avenir
Le projet ROPHARE a fourni des informations inédites sur l’écologie microbienne et la composition des sols agricoles, permettant ainsi de comprendre le rôle des bactériophages sur l’écologie et l’évolution des micro‑organismes. Fait significatif, la diversité découverte des virus et des bactéries indiquait que l’application d’engrais agricoles modifie la composition microbienne. En se concentrant sur la dynamique des systèmes gérés par l’homme, le projet ROPHARE permettra de mieux comprendre la manière dont l’intervention de l’homme affecte la transmission des gènes de RAM aux microbiomes animaux et humains. Ces résultats pointent également vers de potentiels agents antimicrobiens ou de potentielles combinaisons antibiotiques capables de freiner la propagation de la RAM. D’un point de vue thérapeutique, l’identification et la caractérisation de nouveaux bactériophages peuvent ouvrir la voie au développement de traitements antimicrobiens alternatifs. «L’analyse moléculaire des bactériophages identifiés nous a permis de déterminer les candidats les plus prometteurs pour les stratégies antimicrobiennes avec une petite capacité de mobilisation des gènes de RAM», souligne Mme Gómez-Sanz. Actuellement, environ 700 000 personnes perdent la vie en raison d’une RAM dans le monde, et ce nombre devrait s’accroître de manière exponentielle d’ici 2050. Les résultats du projet ROPHARE ont le potentiel d’aider les parties prenantes à formuler les stratégies nécessaires d’atténuation des risques. Le fait de connaître les potentiels réservoirs des gènes de RAM dans l’environnement aidera à prendre des décisions relatives à l’utilisation d’engrais à base de déchets animaux dans les systèmes de sols, à la gestion des eaux usées et à la mise en place d’autres stratégies visant à éviter la propagation de la RAM.