Comprensione del ruolo svolto dagli ecosistemi batterici nel flagello dello sviluppo della resistenza agli antibiotici
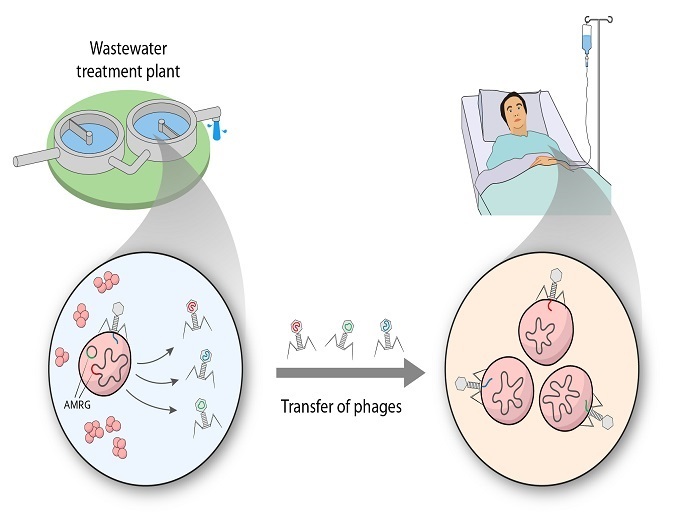
I batteriofagi sono gli organismi più numerosi sulla Terra e svolgono un ruolo centrale nella fisiologia microbica e nell’omeostasi dell’ecosistema. Si tratta di specie particolari che non incidono sulla flora commensale degli esseri umani, tra cui i batteri intestinali, rendendoli adatti come alternativa promettente agli antibiotici per eliminare i batteri patogeni. Tuttavia, dati recenti hanno rivelato che i fagi possono avere un intervallo di ospiti più ampio rispetto a ciò che si pensava tradizionalmente e prove indirette suggeriscono che i batteriofagi possono essere coinvolti nella trasmissione dei geni della resistenza agli antibiotici (AMR, antimicrobial resistance).
Analisi di batteriofagi in ambienti influenzati dagli esseri umani
Il progetto ROPHARE è stato avviato con il supporto del programma Marie Skłodowska-Curie (MSC) ed è finalizzato a studiare il coinvolgimento dei batteriofagi nel trasferimento genico orizzontale dei geni della AMR tra i batteri. I ricercatori hanno lavorato secondo la teoria che la crescita globale nella resistenza agli antibiotici non può essere spiegata esclusivamente sulla base di prescrizioni antibiotiche inappropriate. «C’è un consenso crescente sul fatto che le comunità microbiche, gli antibiotici e i geni della AMR provenienti da diversi ecosistemi collaborano per diffondere i geni della AMR e propagare la resistenza», spiega Elena Gómez-Sanz, borsista di MSC. Per studiare questa complessa interazione, i ricercatori hanno analizzato due sistemi ambientali gestiti dall’uomo: i terreni agricoli e un impianto per il trattamento delle acque reflue. Hanno isolato e caratterizzato circa 100 nuovi batteriofagi stafilococchi nelle acque dell’impianto per il trattamento delle acque reflue (non trattate e trattate) e hanno ricavato il materiale genetico di comunità microbiche dal terreno agricolo. Questo ha consentito loro di scoprire centinaia di nuovi batteriofagi ambientali e di stabilire se i batteriofagi trasmettevano i geni della AMR e come mediavano la loro diffusione all’intera comunità. I risultati hanno rivelato inoltre che diversi ceppi di stafilococchi possono trasferire, sebbene in basse percentuali, geni specifici della resistenza a specie clinicamente pertinenti, mettendo in evidenza l’importanza della rete dei batteriofagi stafilococchi-batteri. Tutto ciò è avvenuto tramite i plasmidi, piccole porzioni circolari di DNA separate dal cromosoma batterico principale. A seguito di analisi bioinformatiche estensive e del sequenziamento, gli scienziati hanno individuato un numero senza precedenti di nuovi batteriofagi, così come nuovi geni della AMR. La maggior parte dei batteriofagi individuati mostrava un ampio intervallo degli ospiti, in grado di infettare ceppi multifarmaco-resistenti clinicamente pertinenti, e alcuni portavano i geni della AMR di importanza clinica. L’annotazione dei nuovi geni della AMR identificati farà progredire le conoscenze esistenti sulla genetica della resistenza.
Significato e prospettive future di ROPHARE
ROPHARE ha fornito informazioni senza precedenti sull’ecologia microbica e sulla composizione dei terreni agricoli, contribuendo alla comprensione del ruolo svolto dai batteriofagi nell’ecologia e nell’evoluzione dei microrganismi. La diversità sui virus e sui batteri che è stata scoperta ha suggerito in modo significativo che l’applicazione dei fertilizzanti agricoli modifica la composizione microbica. Concentrandosi sulle dinamiche dei sistemi gestiti dall’uomo, ROPHARE contribuirà a comprendere meglio come l’intervento umano condizioni la trasmissione dei geni della AMR ai microbiomi degli animali e degli esseri umani. Questi risultati possono anche puntare verso potenziali combinazioni di antibiotici o di agenti antimicrobici in grado di contenere la diffusione della resistenza agli antibiotici. Da una prospettiva terapeutica, l’individuazione e la caratterizzazione di nuovi batteriofagi possono aprire la strada allo sviluppo di trattamenti antimicrobici alternativi. «L’analisi molecolare dei batteriofagi individuati ci ha permesso di stabilire i candidati più promettenti per strategie antimicrobiche con una ridotta capacità di mobilizzazione dei geni della AMR», sottolinea Gómez-Sanz. Attualmente, nel mondo circa 700 000 persone muoiono a causa della resistenza agli antibiotici, un numero che si prevede cresca esponenzialmente entro il 2050. I risultati di ROPHARE hanno il potenziale per aiutare le parti interessate a preparare le strategie necessarie per ridurre i rischi. Conoscere il potenziale serbatoio dei geni della AMR nell’ambiente contribuirà a prendere decisioni sull’utilizzo di fertilizzanti di origine animale nei sistemi dei terreni, sulla gestione delle acque reflue e su altre strategie per evitare la diffusione della resistenza agli antibiotici.