La función de los ecosistemas bacterianos en la lacra del desarrollo de la resistencia a los antibióticos
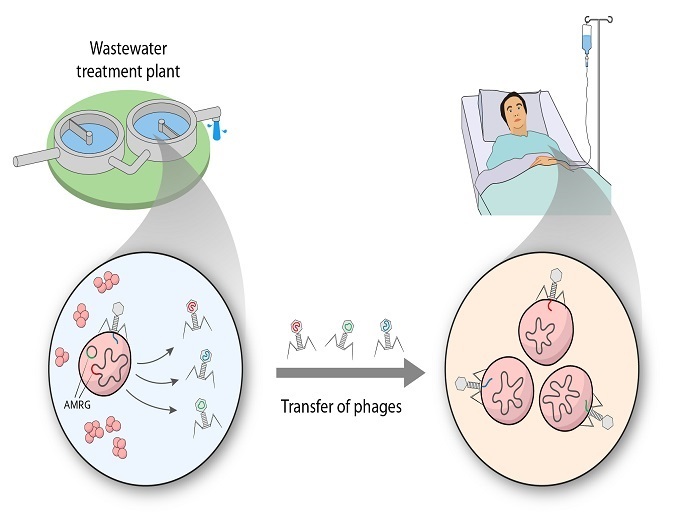
Los bacteriófagos son los organismos más abundantes en la Tierra y tienen un papel fundamental en la fisiología microbiana y en la homeostasis de los ecosistemas. Son especies concretas y no afectan a la flora humana, como las bacterias intestinales, lo que los convierte en una alternativa prometedora a los antibióticos para matar las bacterias patógenas. Sin embargo, datos recientes muestran que los fagos podrían tener una gama de hospedadores más amplia de lo que se pensaba y las pruebas recientes sugieren que los bacteriófagos podrían estar implicados en la transmisión de los genes de RAM.
Investigación de los bacteriófagos en entornos afectados por el ser humano
El proyecto ROPHARE se llevó a cabo el apoyo de las acciones Marie Skłodowska-Curie (MSC) con el objetivo de investigar la implicación de los bacteriófagos en la transferencia horizontal de genes de RAM entre bacterias. Los investigadores trabajaron con la teoría de que el aumento general de la RAM no puede explicarse basándose solo en la prescripción inadecuada de antibióticos. «Hay cada vez mayor consenso en que las comunidades microbianas, los antibióticos y los genes de RAM de ecosistemas diferentes cooperan en la diseminación de los genes de la RAM y la propagación de la resistencia», explica la beneficiaria de una beca individual de investigación MSC Elena Gómez-Sanz. Para estudiar esta interacción compleja, los investigadores estudiaron dos sistemas medioambientales gestionados por el hombre: el suelo agrícola y una planta de tratamiento de aguas residuales (PTAR). Aislaron y caracterizaron cerca de cien nuevos bacteriófagos de los estafilococos en aguas (tratadas y sin tratar) de una PTAR y extrajeron el material genético de comunidades microbianas de suelo agrícola. Esto les permitió hallar cientos de nuevos bacteriófagos medioambientales y determinar si tenían genes de RAM y cómo interceden en su propagación a toda la comunidad. Los resultados revelaron también que varias cepas de estafilococos pueden transferir, aunque en tasas bajas, genes de resistencia específicos a especies relevantes desde el punto de vista clínico, lo que destaca la importancia de la red de bacterias y bacteriófagos de los estafilococos. Esta transferencia se produjo entre plásmidos, pequeños fragmentos circulares de ADN separados del cromosoma bacteriano principal. Tras la secuenciación y amplios análisis bioinformáticos, los científicos identificaron un número sin precedentes de bacteriófagos nuevos, así como nuevos genes de RAM. La mayoría de los bacteriófagos identificados presentaban una amplia gama de huéspedes, al ser capaces de infectar cepas multirresistentes clínicamente relevantes, y algunos portaban genes de RAM de importancia clínica. Las anotaciones sobre los nuevos genes de RAM identificados mejorarán los conocimientos existentes sobre la genética de la resistencia.
Importancia de ROPHARE y perspectivas de futuro
ROPHARE proporcionó una información sin precedentes sobre la ecología microbiana y la composición de los suelos agrícolas, ayudando así a comprender el papel de los bacteriófagos en la ecología y la evolución de los microorganismos. Resulta significativo que la diversidad que descubrieron de virus y bacterias indicaba que la aplicación de fertilizantes agrícolas modifica la composición microbiana. Al centrarse en la dinámica de sistemas gestionados por el hombre, ROPHARE contribuirá a obtener una mejor comprensión sobre cómo afecta la intervención humana a la transmisión de genes de RAM a los microbiomas animales y humanos. Estos resultados también pueden señalar agentes antimicrobianos potenciales o combinaciones de antibióticos capaces de detener la propagación de la RAM. Desde una perspectiva terapéutica, la identificación y caracterización de bacteriófagos nuevos puede allanar el camino para el desarrollo de tratamientos antimicrobianos alternativos. «El análisis molecular de los bacteriófagos identificados nos ha permitido determinar los candidatos más prometedores para una estrategia antimicrobiana con poca capacidad de movilización de los genes de RAM», destaca Gómez-Sanz. En la actualidad, aproximadamente 700 000 personas mueren debido a la RAM en todo el mundo, una cantidad que podría aumentar de forma exponencial para 2050. Los resultados de ROPHARE tienen el potencial de ayudar a las partes interesadas a crear las estrategias de mitigación de riesgos necesarias. El conocimiento sobre las posibles acumulaciones de genes de RAM en el medio ambiente ayudará en la toma de decisiones sobre el uso de fertilizantes creados a partir de residuos animales en suelos agrícolas, la gestión de aguas residuales y otras estrategias a fin de evitar la propagación de la RAM.