Bliższe spojrzenie na rolę ekosystemów bakteryjnych w nasilonym rozwoju antybiotykooporności
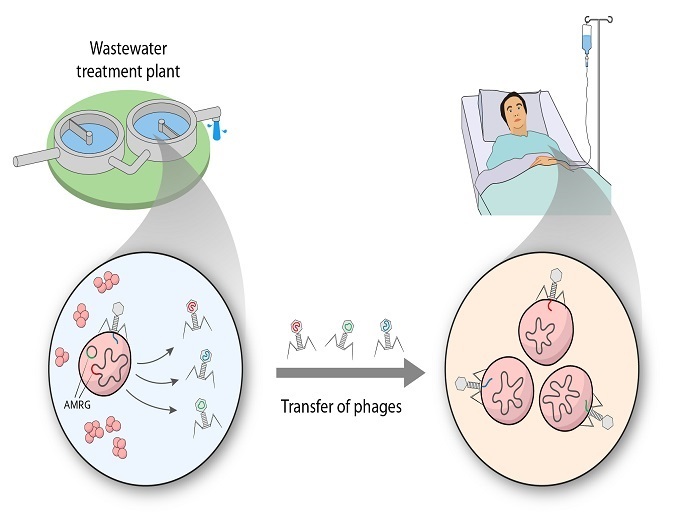
Bakteriofagi to organizmy najpowszechniej występujące na Ziemi, które odgrywają kluczową rolę w fizjologii i homeostazji ekosystemu. Są specyficzne dla konkretnego gatunku i nie wpływają na florę fizjologiczną człowieka, na przykład florę jelitową, co sprawia, że stanowią one obiecującą alternatywę dla antybiotyków w zwalczaniu patogennych bakterii. Jednak najnowsze dane wykazały, że fagi mogą mieć więcej gospodarzy niż wcześniej twierdzono, a pewne dowody sugerują, że mogą one ponadto pośredniczyć w transferze genu AMR.
Badanie bakteriofagów w środowiskach kontrolowanych przez człowieka
Przeprowadzony przy wsparciu z działania „Maria Skłodowska-Curie” (MSC) projekt ROPHARE miał na celu zbadanie roli bakteriofagów w poziomym transferze genów AMR wśród bakterii. Punktem wyjścia dla badań naukowców była teoria zakładająca, że globalny wzrost oporności na środki przeciwdrobnoustrojowe nie może być jedynie wynikiem niewłaściwie przepisywanych antybiotyków. „Coraz więcej naukowców jest zdania, że w transferze genów AMR i wynikającej z niego oporności biorą udział kolonie bakteryjne, antybiotyki i geny AMR z innych ekosystemów”, wyjaśnia stypendystka MSC, Elena Gómez-Sanz. Chcąc poznać tę złożoną interakcję naukowcy zbadali dwa ekosystemy zarządzane przez człowieka – glebę rolną i oczyszczalnię ścieków. Wyizolowali i scharakteryzowali około 100 nowych bakteriofagów gronkowca obecnych w wodzie w oczyszczalni ścieków (przed i po jej oczyszczeniu) oraz pobrali materiał genetyczny z kolonii bakterii z gleby rolnej. Umożliwiło im to odkrycie setek nowych bakteriofagów znajdujących się w środowisku oraz ustalenie, czy bakteriofagi są nosicielami genów AMR i jak pośredniczą w ich rozprzestrzenianiu. Wyniki wykazały także, że kilka szczepów może przenosić (chociaż w mniejszym stopniu) konkretne geny oporności na klinicznie istotne gatunki, co podkreśla znaczenie sieci bakteriofagi gronkowca–bakterie. Odbywało się to za pośrednictwem plazmidów – małych okrągłych cząsteczek pozachromosomowego DNA. Wykorzystując sekwencjonowanie i szeroko zakrojoną analizę bioinformatyczną, naukowcy rozpoznali bezprecedensową liczbę nowych bakteriofagów i nowych genów AMR. Większość zidentyfikowanych bakteriofagów charakteryzowała się szeroką gamą gospodarzy i była w stanie zaatakować ważne wielolekooporne szczepy. Niektóre z kolei były nosicielami genów AMR istotnych z klinicznego punktu widzenia. Opisanie nowo rozpoznanych genów AMR poprawi wiedzę, jaką obecnie dysponujemy na temat genetyki oporności.
Znaczenie projektu ROPHARE i perspektywy na przyszłość
Zespół projektu ROPHARE dostarczył niezwykle cennych informacji na temat ekologii bakterii i składu gleby rolnej, pogłębiając naszą wiedzę dotyczącą roli bakteriofagów w ekologii i ewolucji mikroorganizmów. Odkryta przez naukowców różnorodność wirusów i bakterii udowodniła, że stosowanie nawozów zmienia skład bakteryjny gleby. Skupiając się na dynamice systemów zarządzanych przez człowieka, projekt ROPHARE pomoże wyjaśnić wpływ działalności człowieka na transmisję genów AMR do mikrobiomów ludzkich i zwierzęcych. Rezultaty projektu mogą pomóc zespołowi zidentyfikować potencjalne środki przeciwdrobnoustrojowe lub połączenia antybiotyków, które mają szansę zatrzymać rozprzestrzenianie się AMR. Identyfikacja i scharakteryzowanie nowych bakteriofagów może przygotować grunt pod stworzenie alternatywnych terapii przeciwdrobnoustrojowych. „Dzięki analizie cząsteczkowej rozpoznanych przez nas bakteriofagów byliśmy w stanie wskazać najbardziej obiecujących kandydatów do zastosowania w strategiach przeciwdziałania drobnoustrojom, charakteryzujących się małą zdolnością do mobilizacji genu AMR”, podkreśla Gómez-Sanz. Dziś na całym świecie około 700 000 ludzi umiera w wyniku oporności bakterii na środki przeciwdrobnoustrojowe. Szacuje się, że liczba ta wzrośnie wykładniczo do 2050 roku. Rezultaty projektu ROPHARE mogą pomóc interesariuszom opracować konieczne strategie łagodzenia ryzyka. Znajomość potencjalnych źródeł genów AMR przyczyni się do podejmowania trafniejszych decyzji dotyczących wykorzystania nawozów z odpadów zwierzęcych do użyźniania gleb, w zarządzaniu ściekami i innych strategiach ukierunkowanych na ograniczanie oporności na środki przeciwdrobnoustrojowe.