Mechanismen der Endozytose entschlüsselt
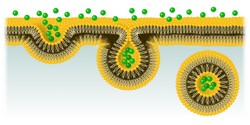
Die Zellmembran ist die Schnittstelle zwischen einer Zelle und ihrer Mikroumgebung, an der viele lebenswichtige Prozesse ablaufen, wie etwa die Kommunikation mit anderen Zellen, Bindung an die extrazelluläre Matrix und Bewegung. Bei der Absorption von Nährstoffen und Signalmolekülen nutzen Zellen einen besonderen Aufnahme- und Transportmechanismus, nämlich die sogenannte Clathrin-vermittelte Endozytose (clathrin-mediated endocytosis, CME). Obwohl man annimmt, dass Fehlfunktionen in der CME einige Krankheiten verursachen, ist die Funktionsweise hinter dem Prozess selbst bisher noch nicht vollständig geklärt. Forscher im EU-finanzierten Projekt CME-REG wollten den Mechanismus, der diesen Prozess auslöst, genau beschreiben. Dazu konzentrierten sie sich auf die Hauptkomponenten: die Lipide der Zellmembran, die zu transportierende Fracht und die Adapterproteine. „Wir wollten die Schritte der Endozytose einzeln analysieren und herausfinden, welchen Schlüsselfaktoren sie unterliegen, welche auch Teil von Krankheiten sein könnten, die Zellsignale zerstören“, erklärt Projektkoordinatorin Dr. Zuzana Kadlecova. Steuerung von CME Bei der CME docken Nährstoffe oder Makromoleküle, die in die Zelle eintreten wollen, an Rezeptoren in spezifischen Bereichen am äußeren Teil der Zellmembran an. Dann werden sie von kleinen Vesikeln umflossen, die mit dem Protein Clathrin ummantelt sind. Mit Live-CellI-Imaging wurde sichtbar, dass CME damit beginnt, dass sich Clathrin und andere Adapterproteine in Form von clathrinbeschichteten Vertiefungen (clathrin-coated pits, CCP) an der Zytoplasmaoberfläche der Membran anlagern. Um die dynamischen Vorgänge bei der CME festhalten und analysieren zu können, haben die Wissenschaftler einen eigenen Arbeitsablauf entwickelt. Sie betrachten die Basalmembran von Zellen, die kleine Abweichungen in der Sequenz des für die Endozytose wichtigen Proteins AP2 haben. Dafür nutzen sie quantitatives fluoreszentes Live-CellI-Imaging. AP2 ist eines der Proteine, die sich von der Hefe bis zum Menschen kaum evolutionär entwickelt haben, und frühere Studien zeigen, dass AP2-Komplexe bei der Ansammlung von CCP eine wichtige Rolle als Auslöser spielen. Interessant ist auch, dass AP2 sofort seine Form ändern kann und gleichzeitig auch seine Funktion und Position. Die Hierarchie der Schritte beim Umschalten in den Aktivmodus des AP2 – also hin zur Einsatzbereitschaft und zur Frachtübernahme – war allerdings bisher unklar. Mithilfe der Mikroskopie lebender Zellen konnten die Forscher tausende CCPs gleichzeitig sichtbar machen. Mit anspruchsvollen Algorithmen zur Teilchenverfolgung und mit mathematischen Analysen wurden dann die Stufen der CME einzeln aufgeschlüsselt sowie die sequenziellen Konformationsänderungen, die das AP2 so aktivieren, dass es die Bildung von CCP auslöst und stabilisiert. Das Team hat entdeckt, dass die wachsende Vertiefung an der Plasmamembran nur stabilisiert werden und reifen kann, wenn sich eine Fracht an das AP2 bindet. Zellen mit Mutationen in bestimmten AP2-Untereinheiten zeigten signifikant weniger Polymerisation von Clathrin in CCP. Damit wird deutlich, wie wichtig die spezifischen Bindungsstellen für die Aktivierung des AP2 sind. Die Erkenntnisse aus CME-REG entsprechen eindeutig dem Modell der Konformationsänderung im AP2, bei dem das Protein zwischen einem geschlossenen, für Fracht unzugänglichen Zustand und einer offenen, aktiven Konformation wechselt. Den Projektergebnissen zufolge treibt die AP2-Steuerung diese Konformationsänderungen voran und ist für die Stabilisierung entstehender CCPs verantwortlich. Bedeutung der Ergebnisse Mit ihrem hoch interdisziplinärem Ansatz konnten die Forscher in CME-REG die molekularen Mechanismen enträtseln, die der Steuerung der Entstehungsphase von CME zugrunde liegen. Dr. Kadlecova konnte in Echtzeit zeigen, wie AP2 als Koordinator die Auswahl der aufzunehmenden Fracht organisiert und wie die Bildung von CCP von der Entstehung bis zur Auflösung genau aussieht. Obwohl sich alle Ergebnisse auf die zellulare Ebene beziehen, können sie mit Sicherheit auf In-vivo-Situationen übertragen werden. Da AP2 auch bei der normalen Entwicklung von Embryos eine unverzichtbare Rolle spielt, bieten die Ergebnisse zudem grundlegendes Wissen über Ereignisse in frühen Lebensphasen. Vor allem aber helfen sie dabei, die molekulare Ätiologie vieler Krankheiten zu verstehen, die mit gestörter Endozytose einhergehen.