Nuevos conocimientos mecanicistas sobre la endocitosis
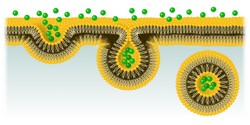
La membrana celular constituye el medio que separa la célula de su microentorno y rige toda una serie de procesos esenciales como la comunicación celular, la adhesión a la matriz extracelular y el movimiento. Para incorporar nutrientes y moléculas de señalización, las células emplean una ruta especializada de internalización y transporte denominada endocitosis mediada por clatrina (EMC). Si bien la desregulación de la EMC está relacionada con varias enfermedades, aún no se conoce muy bien el mecanismo que regula este proceso. Los investigadores del proyecto financiado con fondos europeos CME-REG trabajaron en aras de describir el mecanismo que desencadena este proceso, prestando especial atención a los principales componentes clave, a saber: los lípidos de la membrana plasmática, la carga a transportar y las proteínas adaptadoras. «Nuestro objetivo era examinar las etapas de la endocitosis e identificar los factores reguladores clave, que también podrían participar en el desarrollo de algunas enfermedades relacionadas con el mal funcionamiento de la señalización celular», explica la doctora Zuzana Kadlecova, coordinadora del proyecto. La regulación de la EMC Durante la EMC, los nutrientes o las macromoléculas tienen que unirse a receptores localizados en regiones específicas de la superficie externa de la membrana celular para entrar en la célula. La internalización posterior tiene lugar en unas vesículas de pequeño tamaño recubiertas por la proteína clatrina. Imágenes de células vivas muestran que el proceso de la EMC comienza con la localización de la clatrina y otras proteínas adaptadoras en las vesículas recubiertas de clatrina (VRC) situadas en la parte de la membrana plasmática que está en contacto con el citoplasma. Para visualizar y analizar la dinámica del proceso de la EMC, los investigadores desarrollaron un flujo de trabajo basado en la microscopía de fluorescencia cuantitativa «in vivo» a fin de obtener imágenes de la membrana basal de células que tienen pequeñas alteraciones en la secuencia de la principal proteína endocítica, la AP2. La AP2 es una de las proteínas más conservadas a lo largo de la evolución, desde la levadura hasta los seres humanos, y estudios bioquímicos previos ponen de manifiesto que los complejos AP2 tienen un papel bien definido en la iniciación del ensamblaje de las VRC. Curiosamente, la AP2 puede cambiar instantáneamente de una forma a otra y modificar a la vez su función y localización. Sin embargo, hasta ahora se desconocía la jerarquía de las etapas relacionadas con la activación de la AP2 en su conformación funcional, lista para actuar y la captura la carga. Mediante análisis de microscopía celular «in vivo», los investigadores fueron capaces de visualizar a la vez miles de VRC. También emplearon algoritmos de rastreo de partículas y análisis matemáticos avanzados para estudiar las etapas de la EMC y los cambios conformacionales secuenciales que conducen a la activación de la AP2 para iniciar y estabilizar la formación de las VRC. El equipo descubrió que la unión de la carga a la AP2 es absolutamente esencial tanto para la estabilización de la vesícula en formación en la membrana plasmáticas como para su maduración. Células con mutaciones en subunidades específicas de la AP2 presentaron una menor tasa de polimerización de la clatrina en los sitios de formación de las VRC, lo que pone de manifiesto de manera clara la importancia de los sitios de unión específicos para la activación de la AP2. Los descubrimientos de CME-REG respaldan sin duda el modelo de cambio conformacional de la AP2, en el que la proteína alterna entre un estado cerrado inaccesible para la carga, y un estado abierto activo. Los resultados del proyecto demuestran que la regulación de la AP2 rige estos cambios conformacionales y, además, es responsable de estabilizar las VRC de nueva síntesis. Repercusión de los resultados Gracias al empleo de un método interdisciplinar, los investigadores de CME-REG lograron identificar los mecanismos moleculares que subyacen a la regulación de los primeros estadios de la EMC. La doctora Kadlecova descubrió en tiempo real cómo la AP2 controla la selección de carga para su internalización y su papel como conductor o ensamblador de las VRC, desde su síntesis hasta su degradación. Aunque los hallazgos del proyecto se obtuvieron a nivel celular, lo más probable es que estos puedan extrapolarse a condiciones «in vivo». Dado el papel primordial que la AP2 desempeña en el desarrollo embrionario normal, los resultados también proporcionan conocimientos básicos sobre los eventos que tienen lugar durante las primeras etapas de la vida. Es más, proporcionan la base para comprender la etiología molecular de muchas enfermedades relacionadas con un mal funcionamiento de la endocitosis.