Una mutazione che influisce sulla forma di una proteina ne determina l’attivazione in alcune forme di leucemia infantile
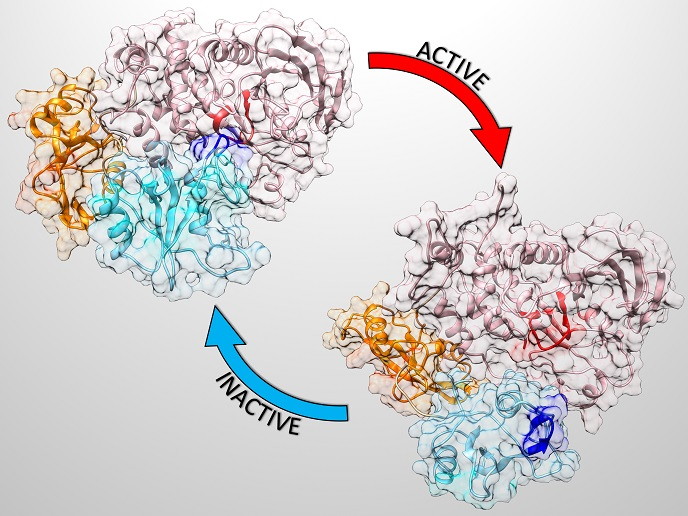
Le proteine sono molecole complesse che svolgono funzioni fondamentali nell’organismo. La proteina SHP2 determina una sovraregolazione dei processi cellulari, al punto che le sue mutazioni causano gravi disturbi dello sviluppo, come la sindrome di Noonan(si apre in una nuova finestra). Mutazioni nel gene SHP2 sono anche all’origine della leucemia mielomonocitica giovanile e sono state osservate anche in altri tumori e neoplasie ematologiche, sebbene più raramente. La proteina SHP2 esiste principalmente in una forma autoinibita (inattiva) e viene attivata completamente solo dopo la specifica associazione con i suoi partner di legame. L’immagine qui accanto permette di vedere le forme molto diverse della proteina inattiva e di quella attiva.
Funzione della proteina e farmaci per il controllo delle mutazioni
«Il progetto MARS ha svelato, a livello atomico, le condizioni che regolano l’attivazione di SHP2. Inoltre, abbiamo costruito un modello atomistico che spiega in che modo determinate mutazioni associate a malattia interferiscono con tale meccanismo», illustra il prof. Jochen Hub, coordinatore del progetto. Il raggiungimento di questi obiettivi è un presupposto importante per la progettazione di farmaci in grado di interferire specificamente con le proteine SHP2 mutanti e di modularne la funzione. Il dominio o area della proteina che riconosce i più importanti partner di legame e blocca il sito attivo di SHP2 nella struttura autoinibita è denominato N-SH2. «Abbiamo scoperto che N-SH2 adotta due distinte conformazioni o forme, di cui solo una è in grado di attivare la proteina», spiega il dott. Massimiliano Anselmi, borsista del programma Marie Skłodowska-Curie che ha collaborato al progetto. È interessante notare che i ricercatori hanno anche evidenziato che l’attivazione non è promossa unicamente dal semplice legame di un biochimica(si apre in una nuova finestra) (ligando), come ritenuto in precedenza, ma dipende invece dal passaggio della popolazione di N-SH2 dalla conformazione o forma non attivante a quella attivante. Ciò significa che la sequenza del ligando e anche il modo particolare in cui si dispone nel sito di legame sono aspetti cruciali nella selezione della conformazione attivante di N-SH2.
Problemi e difficoltà legati alla digestione della proteina
Man mano che le simulazioni fornivano evidenze sempre più convincenti a supporto del modello di attivazione di N-SH2, il gruppo si è reso conto che la maggior parte dei dati sperimentali precedentemente disponibili non potevano essere interpretati in maniera inequivocabile. «Benché nulla contraddicesse di fatto le nostre conclusioni, nulla sembrava confermarle in maniera conclusiva», ricorda il dott. Anselmi. Il problema fondamentale, spiega, «è che le sequenze peptidiche che attivano N-SH2 vengono anche parzialmente digerite (più precisamente, defosforilate) da N-SH2, il che rende un’interpretazione quantitativa degli esperimenti estremamente problematica». La risposta è giunta da una mutazione descritta oltre 10 anni fa. «Abbiamo osservato che gli effetti strutturali di questa mutazione patogena interessano la regione di N-SH2 che subisce un riarrangiamento durante l’attivazione e potevano essere chiaramente spiegati soltanto utilizzando il nostro modello», afferma con entusiasmo. «È stato un lavoro stupefacente e decisivo», aggiunge il prof. Hub.
Chiarimento dei dati confusi e passi avanti verso la comprensione del meccanismo di attivazione
La conoscenza del meccanismo di attivazione di SHP2 e la possibilità di indurlo artificialmente in esperimenti di laboratorio permette di dare risposta a ulteriori domande. Il dott. Anselmi cita solo uno degli esempi: «Utilizzando i dati ottenuti mediante diffusione dei raggi X a piccoli angoli (SAXS), sarà possibile identificare la struttura tridimensionale dello stato aperto di SHP2, a ulteriore conferma della via di attivazione proposta». Le conclusioni fornite dal progetto MARS hanno messo in discussione e confutato varie opinioni diffuse circa l’attivazione di SHP2. «Spesso le enormi moli di dati riportati in letteratura sono disperse e in certo modo confuse, e un modello aiuta a organizzarle e riordinarle in modo razionale», sintetizza il prof. Hub.