Wpływający na mutację kształt białka decyduje o aktywacji choroby w przypadku niektórych białaczek wieku dziecięcego
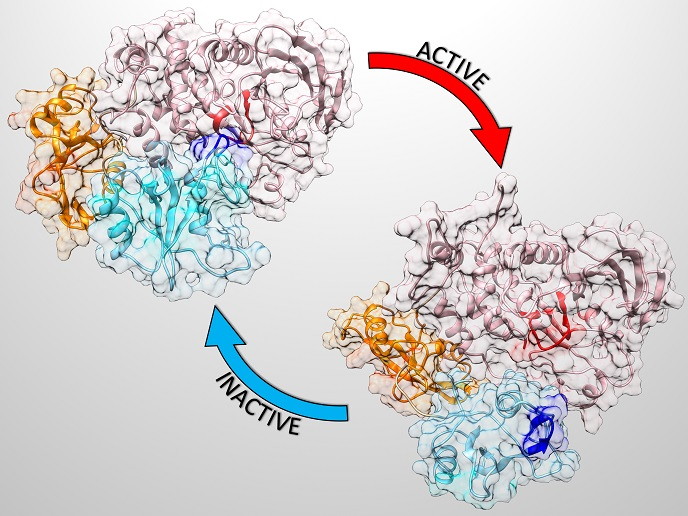
Białka to złożone cząsteczki odgrywające w organizmie wiele kluczowych ról. Białko SHP2 odpowiada za regulację procesów komórkowych w górę. Jest to tak ważna cząsteczka, że jej mutacje powodują poważne zaburzenia rozwojowe, takie jak zespół Noonan(odnośnik otworzy się w nowym oknie). Mutacje genu SHP2 powodują także wystąpienie wczesnodziecięcej białaczki nielimfocytowej, a nieco rzadziej wykrywane są u pacjentów cierpiących na inne zaburzenia hematologiczne i choroby nowotworowe. Białko SHP2 występuje głównie w formie nieaktywnej (autoinhibowanej) i jest w pełni aktywowane tylko po specyficznej asocjacji z dedykowanymi mu substancjami wiążącymi. Rysunek powyżej przedstawia bardzo odmienne postaci białka nieaktywnego i aktywnego.
Funkcje białek i leki do kontrolowania mutacji
„Projekt MARS umożliwił odkrycie, w jakich okolicznościach dochodzi do aktywacji SHP2 na poziomie atomowym. Ponadto, stworzyliśmy atomistyczny model wyjaśniający, w jaki sposób pewne związane z chorobami mutacje zaburzają ten mechanizm”, opowiada koordynator projektu prof. Jochen Hub. Osiągnięcie tych celów jest ważne z punktu widzenia projektowania leków wchodzących specyficznie w interakcje krzyżowe z mutantami SHP2 i modulujących ich funkcje. N-SH2 to domena (obszar) białka, który odpowiada za rozpoznawanie najważniejszych substancji wiążących i blokuje centrum aktywne białka SHP2 będącego w formie autoinhibowanej. „Ustaliliśmy, że N-SH2 przyjmuje dwie wyraźnie odmienne konformacje (kształty), z których tylko jedna skutkuje aktywacją”, wyjaśnia dr Massimiliano Anselmi, pracujący w projekcie stypendysta programu „Maria Skłodowska-Curie”. Co ciekawe, badacze odkryli również, że do aktywacji nie wystarcza prosty proces wiązania chemia(odnośnik otworzy się w nowym oknie) (ligandu), jak wcześniej sądzono, ale dochodzi do niej za sprawą zmiany N-SH2 z konformacji nieaktywującej do aktywującej. Oznacza to, że sekwencja ligandu, a nawet określony sposób zmiany struktury do postaci miejsca wiązania są kluczowymi aspektami w procesie selekcji aktywującej konformacji N-SH2.
Problemy z trawieniem i inne wyzwania
Symulacje coraz bardziej przemawiały za modelem aktywacji za pośrednictwem N-SH2, dlatego zespół projektu zrozumiał, że większość dostępnych dotąd danych doświadczalnych nie mogła być interpretowana jednoznacznie. „Choć nic w zasadzie nie przeczyło naszym wnioskom, nic też jednoznacznie ich nie potwierdzało”, wspomina dr Anselmi, wyjaśniając dalej, że kluczowy problem „wynika z faktu, że peptydowe sekwencje aktywacyjne N-SH2 są także częściowo trawione (a mówiąc ściślej: defosforylowane) przez N-SH2, przez co ilościowa interpretacja doświadczeń jest ogromnym wyzwaniem”. Odpowiedź przyniosła mutacja, o której świat usłyszał ponad 10 lat temu. „Odkryliśmy, że strukturalne skutki tej patogennej mutacji wpływają na ten region N-SH2, który podlega reorganizacji podczas aktywacji, co można by klarownie wytłumaczyć wyłącznie z użyciem naszego modelu”, opowiada. „To zdumiewające i decydujące odkrycie płynące z naszych prac”, dodaje prof. Hub.
Wyjaśnianie niejasności i kroki w kierunku zrozumienia mechanizmu aktywacji
Znajomość mechanizmu aktywacji białka SHP2 i możliwość jej wzbudzania w toku doświadczeń laboratoryjnych pozwala znaleźć odpowiedzi na kolejne pytania. Dr Anselmi przytacza pewien przykład: „Przy użyciu danych pozyskanych dzięki technice niskokątowego rozpraszania promieniowania rentgenowskiego (SAXS) możliwa będzie identyfikacja trójwymiarowej struktury białka SHP2 w stanie otwartym, co potwierdzi słuszność zaproponowanej przez nas ścieżki aktywacyjnej”. Wnioski płynące z projektu MARS podważyły i odrzuciły kilka powszechnie uznawanych poglądów na temat aktywacji SHP2. „Często duże ilości danych w doniesieniach naukowych są fragmentaryczne i niejasne, a model pomaga je zorganizować i uporządkować w sposób racjonalny”, podsumowuje prof. Hub.