Proteinform beeinflusst Mutationen und bestimmt die Aktivierung einiger kindlicher Leukämien
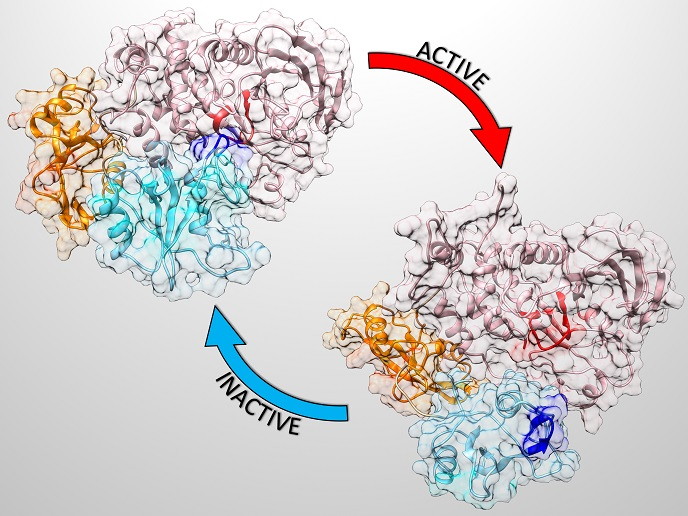
Proteine sind komplexe Moleküle, die eine entscheidende Rolle im Körper spielen. Das SHP2-Protein verstärkt zelluläre Prozesse derart, dass seine Mutationen schwere Entwicklungsstörungen wie das Noonan-Syndrom(öffnet in neuem Fenster) hervorrufen. Mutationen im SHP2-Gen führen außerdem zu juveniler myelomonozytischer Leukämie und treten seltener in anderen hämatologischen Malignomen und Tumoren auf. SHP2 tritt hauptsächlich in einer automatisch gehemmten (inaktiven) Form auf und wird erst vollständig aktiviert, wenn es eine konkrete Verbindung mit seinen Bindungspartnern eingeht. In der obigen Abbildung sind die verschiedenen Formen eines inaktiven und aktiven Proteins dargestellt.
Proteinfunktion und Wirkstoffe zur Steuerung von Mutationen
„Das MARS-Projekt hat auf atomarer Ebene die Umstände aufgedeckt, die für die Aktivierung von SHP2 verantwortlich sind. Außerdem haben wir ein atomistisches Modell erstellt, das erklärt, wie bestimmte krankheitsauslösende Mutationen einen solchen Mechanismus stören“, so der Projektkoordinator, Prof. Jochen Hub. Das Erreichen dieser Ziele ist eine wichtige Voraussetzung für die Entwicklung von Wirkstoffen, die vor allem SHP2-Mutationen stören und ihre Funktion modulieren. N-SH2 ist die Proteindomäne bzw. der Proteinbereich, der die wesentlichen Bindungspartner erkennt und das aktive Zentrum von SHP2 in der automatisch gehemmten Struktur blockiert. „Wir haben herausgefunden, dass N-SH2 zwei ausgeprägte Konformationen bzw. Formen annimmt, von denen nur eine aktiviert wird“, erklärt Dr. Massimiliano Anselmi, der Marie-Skłodowska-Curie-Stipendiat des Projekts. Interessanterweise stellten die Forscher außerdem fest, dass die Aktivierung nicht, wie zuvor angenommen, allein durch die einfache Bindung eines Liganden(öffnet in neuem Fenster) gefördert wird, sondern durch die Verschiebung der Population von N-SH2 von der nicht aktivierenden zur aktivierenden Konformation oder Form. Das bedeutet, dass die Ligandensequenz und sogar die Art, wie sie sich an die Bindungsstelle einfügt, entscheidende Aspekte bei der Auswahl der aktivierenden Konformation von N-SH2 sind.
Verdauungsprobleme und Herausforderungen
Da die Simulationen das Modell der N-SH2-Aktivierung zunehmend stützten, stellt das Team fest, dass der Großteil der bisher vorhandenen Versuchsdaten nicht eindeutig interpretiert werden kann. „Trotz der Tatsache, dass nichts im Widerspruch zu unseren Ergebnissen stand, schien sie auch nichts eindeutig zu bestätigen“, erinnert sich Dr. Anselmi. Das Hauptproblem ist, „dass die N-SH2-aktivierenden Peptidsequenzen ebenfalls teilweise von N-SH2 verdaut (oder besser gesagt dephosphoryliert) werden, wodurch eine quantitative Interpretation der Versuche schwierig ist.“ Die Antwort liefert eine Mutation, über die vor mehr als zehn Jahren berichtet wurde. „Wir stellten fest, dass die strukturellen Auswirkungen der pathogenen Mutation die Region von N-SH2 beeinflussen, die sich bei der Aktivierung neu anordnet, und sich anhand unseres Modells eindeutig erklären ließ“, schwärmt er. „Es war eine bemerkenswerte und maßgebliche Arbeit“, ergänzt Prof. Hub.
Klarstellen der unklaren und nächsten Schritte zum Verständnis des Aktivierungsmechanismus
Das Wissen um den Aktivierungsmechanismus von SHP2 und die Möglichkeit, ihn künstlich in Laborversuche einzubinden, wirft weitere Fragen auf, die es zu beantworten gilt. Dr. Anselmi nennt nur ein Beispiel: „Mithilfe von Daten aus der Kleinwinkel-Röntgenstreuung wird es möglich sein, die dreidimensionale Struktur des offenen Zustands von SHP2 zu bestimmen und somit den vorgeschlagenen Aktivierungsweg weiter zu validieren.“ Die Ergebnisse des MARS-Projekts haben viele gängige Ansichten zur SHP2-Aktivierung infrage gestellt und verworfen. „Häufig sind große Mengen von Daten, die aus der Literatur stammen, verstreut und zum Teil unklar. Diese lassen sich mit einem Modell organisieren und auf vernünftige Weise bereinigen“, fasst Prof. Hub zusammen.