El cobre es el metal culpable de la enfermedad de Alzheimer
La enfermedad de Alzheimer (EA) se describió por primera vez oficialmente en 1906; la clasificación «enfermedad de Alzheimer» se incluyó en un libro de texto de psiquiatría unos años más tarde. A pesar de que se han acumulado más de cien años de datos clínicos e investigaciones desde entonces, aún quedan muchas preguntas pendientes. El proyecto aLzINK, financiado por el Consejo Europeo de Investigación (CEI), ha respondido a una significativa, que indica la vía hacia una importante diana para los candidatos a fármaco con posibilidades de prevenir el desarrollo de esta devastadora enfermedad neurológica degenerativa.
No todos los metales son iguales
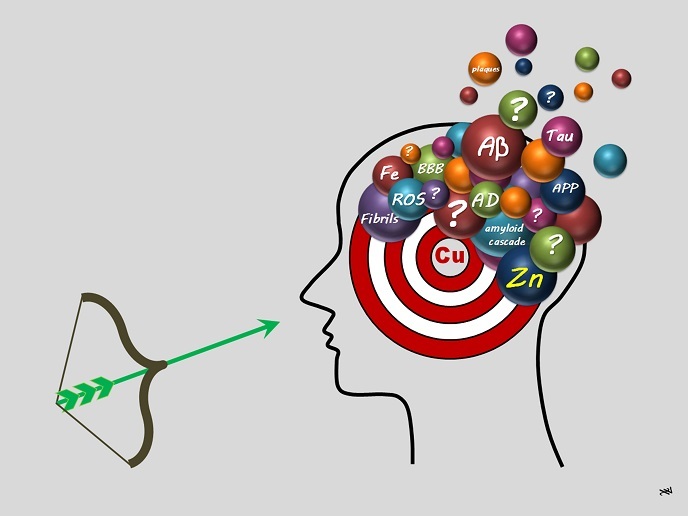
En los últimos treinta años, la hipótesis de la cascada amiloide(se abrirá en una nueva ventana) ha sido un punto clave de la investigación sobre la EA. En ella se propone que la agregación de péptidos amiloide-β(se abrirá en una nueva ventana) (Aβ) (formados por dos o más aminoácidos enlazados en una cadena) son el primer suceso clave y de aparición temprana. El segundo es la formación de especies reactivas del oxígeno (ERO)(se abrirá en una nueva ventana) relacionadas con el estrés oxidativo(se abrirá en una nueva ventana). En la etapa final, los péptidos autoensamblados se reúnen en las llamadas placas seniles, sello distintivo de la enfermedad. La homeostasis de los metales (mantenimiento del equilibrio metálico adecuado que requieren las funciones fisiológicas), en particular, del cobre (Cu) y el zinc (Zn), se ha vinculado a las tres etapas. Christelle Hureau-Sabater, becaria del CEI, explica: «El Cu puede hallarse en dos estados de oxidación: Cu+ y Cu2+. Si bien el Cu puede desencadenar la formación de ERO, el Zn es inerte y no puede hacerlo. Ambos iones enlazan con péptidos Aβ, pero lo hacen de forma diferente, por lo que modulan la agregación de dichos péptidos de manera diferente. Una de las estrategias terapéuticas se basa en eliminar los iones metálicos que se unen a los péptidos Aβ. Se estableció como hipótesis la eliminación selectiva del Cu, lo que dificultaba el diseño de moléculas terapéuticas/candidatos a fármaco (llamados ligandos o quelantes)». El proyecto aLzINK se marcó como objetivo desarrollar directrices para ello.
Superar los retos, dar en la diana terapéutica
El péptido Aβ es una proteína corta, intrínsecamente desordenada y compuesta por unos cuarenta aminoácidos que se deriva de una proteína de membrana más larga. Su flexibilidad y la falta de una estructura tridimensional preformada dificultan la identificación de dónde y cómo se unen el Cu y el Zn al péptido. Según Hureau-Sabater: «Para superar este problema, utilizamos muchas técnicas complementarias, incluida la sofisticada espectroscopia de absorción de rayos X(se abrirá en una nueva ventana) o XAS». La XAS se utiliza ampliamente para determinar la estructura geométrica o electrónica local de la materia, aplicándose radiación de sincrotrón para obtener haces de rayos X intensos y modulables. Gracias a protocolos innovadores y a la colaboración con otros grupos, el equipo de Hureau-Sabater superó los retos y alcanzó con éxito sus objetivos iniciales. «Hemos demostrado con precisión el motivo por el cual los candidatos a fármaco para tratar la EA deben centrarse específicamente en el Cu. Probamos varias moléculas en soluciones y algunas en células, con resultados prometedores». Esta investigación proporciona un punto de partida para futuros estudios sobre el potencial terapéutico de los quelantes (agentes secuestrantes) del Cu y compuestos relacionados. Durante el proceso, los investigadores destacaron también la utilidad de los profármacos inorgánicos en sustitución del ligando endógeno puramente orgánico y descubrieron la importancia de las tasas de intercambio entre los ligandos Aβ, Cu y Zn, así como de establecer como objetivo el estado Cu+ del cobre. Hureau-Sabater concluye: «Han fracasado muchos enfoques terapéuticos para abordar la EA, incluidos algunos dirigidos a los iones metálicos. En aLzINK, hemos demostrado que hay que tener en cuenta muchos criterios y elucidado puntos importantes sobre esos criterios». aLzINK ha abierto una nueva puerta a terapias para la EA dirigidas con mayor precisión, las cuales podrían aumentar los resultados obtenidos y reducir al mínimo efectos secundarios innecesarios.