Kupfer – metallischer Mitverursacher der Alzheimer-Krankheit
Die Alzheimer-Krankheit wurde 1906 erstmals offiziell beschrieben und ihre Klassifikation einige Jahre später in ein Lehrbuch für Psychiatrie aufgenommen. Trotz aller klinischen Daten und Forschungsergebnisse der vergangenen 100 Jahre sind noch immer viele Fragen offen. Das Projekt aLzINK, das durch den Europäischen Forschungsrat (ERC) der EU finanziert wurde, konnte eine wichtige Antwort liefern und damit ein wichtiges Angriffsziel für Wirkstoffkandidaten aufzeigen, mit denen sich das Fortschreiten dieser verheerenden degenerativen Erkrankung des Nervensystems aufhalten lassen könnte.
Metall ist nicht gleich Metall
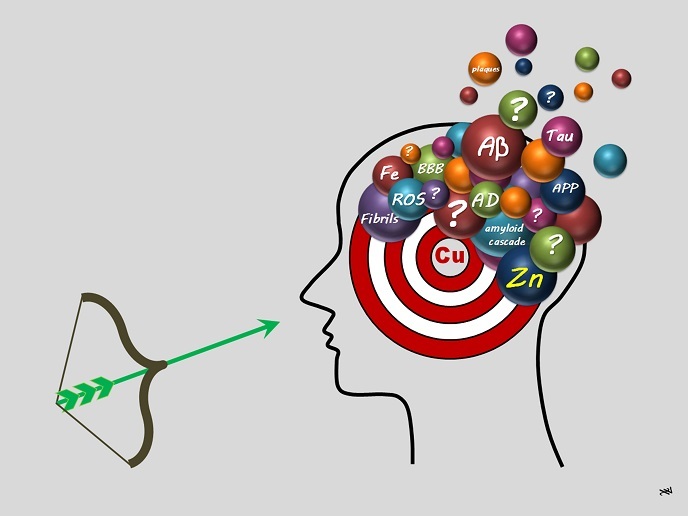
Seit 30 Jahren richtet die Alzheimer-Forschung ihren Blick verstärkt auf die Amyloid-Kaskaden-Hypothese(öffnet in neuem Fenster). Danach ist die Aggregation von Beta-Amyloid-Peptiden(öffnet in neuem Fenster) (Aβ) ein frühes Ereignis der Erkrankung und zugleich das erste entscheidende. Als Peptide bezeichnet man die Verbindung von mindestens zwei Aminosäuren zu einer Kette. Das zweite ist die Bildung von reaktiven Sauerstoffspezies (ROS)(öffnet in neuem Fenster) im Zusammenhang mit oxidativem Stress(öffnet in neuem Fenster). Im Endstadium sammeln sich selbstorganisierte Peptide in sogenannten senilen Plaques, einem typischen Merkmal der Erkrankung. Das Gleichgewicht zwischen den Metallen, von dem physiologische Funktionen abhängig sind, wird durch den Vorgang der sogenannten Metallhomöostase geregelt. Die Metallhomöostase, und zwar insbesondere die von Kupfer (Cu) und Zink (Zn), wurde mit allen drei Ereignissen der Erkrankung in Verbindung gebracht. Wie die ERC-Stipendiatin Christelle Hureau Sabater erklärt: „Kupfer zeigt zwei Oxidationsstufen: Cu+ und Cu2+. Kupfer kann die Bildung von reaktiven Sauerstoffspezies anregen, während Zink inert und daher nicht dazu in der Lage ist. Beide Ionen können sich mit Aβ-Peptiden verbinden, jedoch auf unterschiedliche Weise, sodass sie auch die Aggregation von Aβ-Peptiden unterschiedlich modulieren. Eine bestimmte therapeutische Strategie basiert auf der Entfernung von Metallionen, die an Aβ-Peptide gebunden sind. Wir verfolgten die Hypothese, dass das Kupfer selektiv entfernt werden sollte, was allerdings das Design von therapeutischen Molekülen bzw. Wirkstoffkandidaten [sog. Liganden oder Chelatoren] erschwert.“ Das aLzINK-Projekt arbeitete an der Entwicklung entsprechender Richtlinien.
Herausforderungen bewältigen und therapeutisch ins Schwarze treffen
Das Aβ-Peptid ist ein kurzes, intrinsisch ungeordnetes Protein aus etwa 40 Aminosäuren, das einem längeren Membranprotein entstammt. Aufgrund seiner Flexibilität und der mangelnden vorgeformten dreidimensionalen Struktur lässt sich nur schwer bestimmen, wo und wie Kupfer und Zink an das Peptid binden. Dieses Problem „konnten wir durch den Einsatz mehrerer einander ergänzender Verfahren, wie fortschrittlicher Röntgenabsorptionsspektroskopie(öffnet in neuem Fenster) oder kurz XAS bewältigen“, so Hureau-Sabater. Die Röntgenabsorptionsspektroskopie ist ein übliches Verfahren zur Bestimmung der lokalen geometrischen und/oder elektronischen Struktur der Materie mittels intensiver, durchstimmbarer Röntgenstrahlen, die durch Synchrotronstrahlung erzeugt werden. Dank innovativer Protokolle und der Zusammenarbeit mit anderen Gruppen konnte das Team um Hureau-Sabater die Herausforderungen bewältigen und seine ursprünglichen Ziele erreichen. „Wir konnten genau zeigen, warum Wirkstoffkandidaten zur Alzheimer-Therapie speziell auf Kupfer abzielen sollten. Wir haben mehrere Moleküle in Lösungen und einige in Zellen getestet und dabei vielversprechende Ergebnisse erzielt.“ Damit bietet sich nun ein Ausgangspunkt für die zukünftige Erforschung des therapeutischen Potenzials von Cu-Chelatoren (Komplexbildnern) und verwandten Verbindungen. Im Verlauf konnten die Forschenden außerdem den Nutzen anorganischer Prodrugs gegenüber dem rein organischen Stammliganden hervorheben und entdeckten die Bedeutung der Austauschgeschwindigkeiten zwischen den Liganden Aβ, Cu und Zn und die Bedeutung der Kupfer-Oxidationsstufe Cu+ als Wirkstoffziel. Hureau-Sabater abschließend: „Es sind bereits viele therapeutische Ansätze für die Alzheimer-Krankheit gescheitert, auch solche, die auf Metallionen abzielten. Mit aLzINK haben wir gezeigt, dass für die Erfolgsaussicht solcher Ansätze zahlreiche Kriterien berücksichtigt werden müssen, und konnten wichtige Merkmale zu diesen Kriterien klären.“ aLzINK hat eine neue Tür zu zielgenaureren Alzheimer-Therapien aufgestoßen, die den Nutzen erhöhen und zugleich unnötige Nebenwirkungen vermeiden könnten.