Le cuivre est le métal responsable de la maladie d’Alzheimer
La maladie d’Alzheimer (MA) a été décrite officiellement pour la première fois en 1906 et la classification «maladie d’Alzheimer» a été incluse dans un manuel de psychiatrie quelques années plus tard. Malgré plus de cent ans de données cliniques et de recherches, de nombreuses questions demeurent. Le projet aLzINK, financé par le Conseil européen de la recherche (CER) de l’UE, a répondu à une question importante, indiquant la voie vers une cible importante pour les médicaments candidats susceptibles de prévenir le développement de cette maladie neurologique dégénérative dévastatrice.
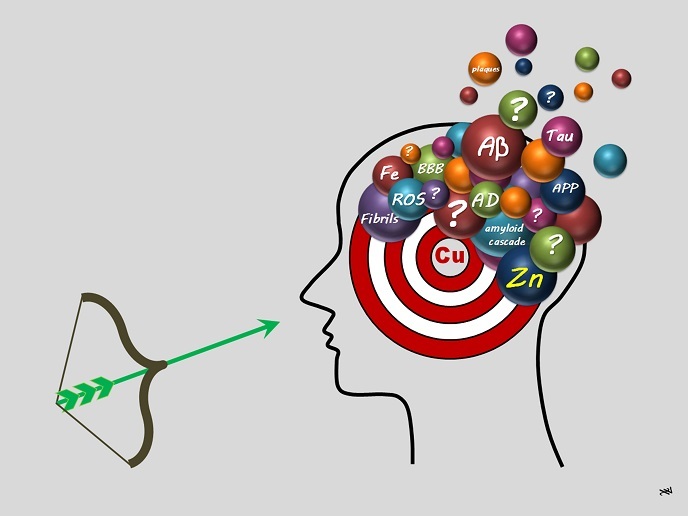
Tous les métaux ne naissent pas égaux
Au cours des 30 dernières années, l’hypothèse de la cascade amyloïde(s’ouvre dans une nouvelle fenêtre) a été au centre des recherches sur la MA. Elle suggère que l’agrégation des peptides amyloïde-β(s’ouvre dans une nouvelle fenêtre) (Aβ), où les peptides sont deux ou plusieurs acides aminés liés dans une chaîne, est un événement précoce et le premier événement clé. Le second est la formation de dérivés réactifs de l’oxygène (DRO)(s’ouvre dans une nouvelle fenêtre) liés au stress oxydatif(s’ouvre dans une nouvelle fenêtre). Au stade final, les peptides auto-assemblés sont regroupés en plaques dites séniles, un trait distinctif de la maladie. L’homéostasie des métaux (maintien de l’équilibre métallique approprié nécessaire au fonctionnement physiologique), en particulier du cuivre (Cu) et du zinc (Zn), a été liée à ces trois étapes. Christelle Hureau-Sabater, bénéficiaire d’une subvention au CER, explique: «Le cuivre peut se trouver dans deux états d’oxydation, Cu+ et Cu2+. Alors que le Cu peut déclencher la formation de DRO, le Zn est inerte et ne peut pas le faire. Les deux ions peuvent se lier aux peptides Aβ, mais de manière différente, modulant ainsi différemment l’agrégation des peptides Aβ. Une stratégie thérapeutique consiste à éliminer les ions métalliques liés aux peptides Aβ. Nous avons émis l’hypothèse que le Cu devrait être éliminé de manière sélective, ce qui rend plus difficile la conception de molécules thérapeutiques/médicaments candidats (appelés ligands ou chélateurs).» Le projet aLzINK s’est fixé pour objectif de développer des lignes directrices pour y parvenir.
Relever les défis, frapper «dans le mille» thérapeutique
Le peptide Aβ est une protéine courte, intrinsèquement désordonnée, d’environ 40 acides aminés, qui est dérivée d’une protéine membranaire plus longue. Sa flexibilité et l’absence d’une structure 3D préformée rendent difficile l’identification de la zone où le Cu et le Zn se lient au peptide et de la manière dont ils le font. Selon Christelle Hureau-Sabater, «nous avons surmonté ce problème en ayant recours à de nombreuses techniques complémentaires, notamment le système sophistiqué de spectroscopie d’absorption des rayons X(s’ouvre dans une nouvelle fenêtre) ou SAX». La SAX est largement utilisée pour déterminer la structure géométrique et/ou électronique locale de la matière en s’appuyant sur le rayonnement synchrotron pour obtenir des faisceaux de rayons X intenses et ajustables. Grâce à des protocoles novateurs et à la collaboration avec d’autres groupes, l’équipe de Christelle Hureau-Sabater a surmonté les obstacles et atteint ses objectifs initiaux. «Nous avons démontré avec précision pourquoi les médicaments candidats contre la MA devraient cibler spécifiquement le Cu. Nous avons testé plusieurs molécules dans des solutions et certaines dans des cellules avec des résultats prometteurs.» Cela constitue un point de départ pour de futures études sur le potentiel thérapeutique des chélateurs du Cu (agents séquestrants) et des composés apparentés. En chemin, les chercheurs ont également souligné l’utilité des promédicaments inorganiques au lieu du ligand parent purement organique et ont découvert l’importance des taux d’échange entre les ligands Aβ, Cu et Zn et du ciblage de l’état Cu+ du cuivre. Christelle Hureau-Sabater conclut: «De nombreuses approches thérapeutiques de la MA ont échoué, y compris celles ciblant les ions métalliques. Avec le projet aLzINK, nous avons démontré que de nombreux critères doivent être pris en compte, et nous avons élucidé des caractéristiques importantes concernant ces critères». aLzINK a ouvert une nouvelle porte sur des thérapies plus précisément ciblées pour la MA qui pourraient accroître les avantages, tout en minimisant les effets secondaires indésirables.