Desentrañar la conexión entre los adipocitos, la inflamación y el microbioma
En 2022, casi el 60 % de los adultos y casi uno de cada tres niños tenían sobrepeso o eran obesos en Europa, señala la Organización Mundial de la Salud(se abrirá en una nueva ventana). Dado que la tendencia no muestra signos de desaceleración, es oportuno comprender mejor la relación entre los cambios que experimenta el tejido adiposo en la obesidad y el impacto que ello podría tener en la inflamación. «En las dos últimas décadas hemos reconocido que la relación entre las funciones e interacciones de nuestras células inmunitarias y las células adiposas blancas, los adipocitos, son de importancia crítica para nuestra salud», afirma Eran Elinav(se abrirá en una nueva ventana), catedrático del Departamento de Inmunología de Sistemas del Instituto Científico Weizmann(se abrirá en una nueva ventana) y director de la División de Microbioma y Cáncer del Centro Alemán de Investigación sobre el Cáncer (DKFZ(se abrirá en una nueva ventana). Elinav, que coordinó el proyecto ADIMMUNE, financiado por el Consejo Europeo de Investigación(se abrirá en una nueva ventana) (CEI), explica que en la mayoría de los casos se desconoce la naturaleza molecular exacta de tales interacciones, como los tipos de subconjuntos celulares que se señalizan entre sí y la naturaleza de esas señalizaciones. «Esto se debe a razones tanto metodológicas como conceptuales. Por ejemplo, la tecnología que permite caracterizar los perfiles de expresión génica de las células individuales, conocida como transcriptómica unicelular, es de desarrollo reciente. Pero el proceso se ve desafiado por las células adiposas, que tienen rasgos particulares». Aún más complejo es desentrañar el impacto que las grandes comunidades de microbios que residen dentro de nuestro cuerpo, nuestro microbioma, tienen en las redes de comunicación entre nuestras células, la dinámica de los tejidos y el efecto concomitante en nuestra salud. «En nuestro proyecto, nos propusimos superar todos estos retos, descodificando funcionalmente las redes de interacción celular en el tejido adiposo, su naturaleza molecular y su regulación por el microbioma intestinal», añade Elinav, que dirige el ElinavLab(se abrirá en una nueva ventana).
Herramientas analíticas integrales
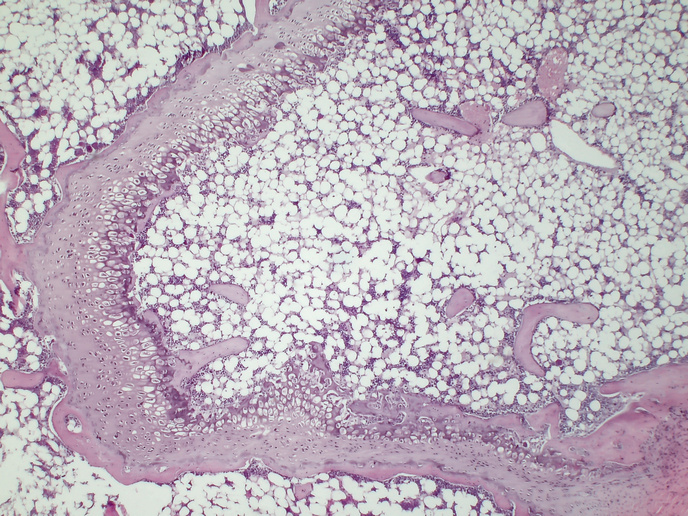
En el proyecto se utilizaron herramientas genómicas, microbiológicas y gnotobiológicas(se abrirá en una nueva ventana) de alto rendimiento (generadas rápidamente) y desarrolladas recientemente, en modelos murinos de nueva generación. El término gnotobiológicas se refiere al hecho de que los modelos murinos estaban libres de gérmenes y luego se colonizaron con cepas específicas de bacterias. El resultado fue que el equipo pudo identificar con precisión a las bacterias provocaban una interacción determinada. Su método exhaustivo también integró un análisis del funcionamiento de los genes de determinadas bacterias del microbioma intestinal, utilizando CRISPR(se abrirá en una nueva ventana), culturomica microbiana(se abrirá en una nueva ventana) y análisis metabólicos «in vivo». Para estos estudios, el equipo de ADIMMUNE recurrió a voluntarios humanos, tanto delgados como obesos, que se sometieron a biopsias de grasa.
Comprender la interacción a nivel unicelular
«Revelamos muchas interacciones desconocidas hasta ahora», añade Elinav. El equipo de Elinav pudo caracterizar tipos de células inmunitarias desconocidas hasta entonces en el tejido adiposo de las cepas de ratones y en voluntarios humanos obesos y delgados. Gracias a esta caracterización en profundidad, en el proyecto se han podido identificar múltiples subconjuntos celulares desconocidos, sus respectivas funciones a nivel unicelular y las redes de comunicación entre las distintas células. «Esto nos permitió establecer la cadena de acontecimientos en la que la alteración de dichas redes de comunicación celular y de expresión génica conduce al desarrollo de la obesidad, la resistencia a la insulina y la afección hepática estrechamente asociada, la esteatosis hepática asociada a la disfunción metabólica», explica Elinav. Sus conclusiones sobre la obesidad se exponen en el artículo publicado en la revista «Cell»(se abrirá en una nueva ventana), mientras que las relativas a la esteatosis hepática aparecen en el artículo publicado en la revista «Nature Medicine»(se abrirá en una nueva ventana). En el proyecto también se abordó una de las formas más dramáticas de obesidad, conocida como el «aumento de peso asociado al abandono del tabaco» (SCWG, por sus siglas en inglés): hasta ahora se desconocía el mecanismo de este fenómeno. En una amplia serie de experimentos con ratones, el equipo pudo demostrar que el SCWG está sustancialmente regulado por los cambios funcionales que se producen en el microbioma intestinal durante el tabaquismo activo, como se explica en otro artículo publicado en «Nature»(se abrirá en una nueva ventana). «Hemos identificado las moléculas mediante las cuales los microbios se comunican con las células adiposas para inducir estos efectos de obesidad», señala Elinav. «Curiosamente, una vez descubiertas, las moléculas también podrían influir en el desarrollo de la obesidad en el contexto de personas no fumadoras». Otro aspecto innovador de la investigación del equipo fue la interacción entre la hiperglucemia y la diabetes, y el mayor riesgo asociado a las infecciones víricas pulmonares, desde la gripe hasta el COVID-19. Se calcula que más del 35 % de los humanos que sufrieron COVID grave potencialmente mortal eran diabéticos. «En un estudio también publicado en "Nature" en 2023(se abrirá en una nueva ventana) demostramos, en ratones, que esta mayor susceptibilidad de los diabéticos a la infección viral pulmonar, procede de los altos niveles de glucosa en su sangre», dice Elinav. Planteó que la glucosa elevada repercute en los circuitos metabólicos de una célula inmunitaria concreta del pulmón, denominada CDC1. En definitiva, esto da lugar a una alteración de la función que permite al virus vencer al sistema inmunitario y generar una infección grave.
Conocimientos funcionales revelan posibles vías de tratamiento
Estas inmersiones profundas en las bases moleculares de la comunicación entre las bacterias que albergamos y las células inmunitarias de nuestro tejido adiposo han dado lugar a conocimientos funcionales que conducen a posibles vías de tratamiento. Elinav está orgulloso de los logros obtenidos en el proyecto: «Establecer estos niveles de comprensión causal y mecanicista permite identificar las dianas terapéuticas, e incluso las moléculas que modulan el desarrollo de la enfermedad. No podríamos haberlo hecho sin el apoyo continuo del CEI».