Die Verbindung zwischen Fettzellen, Entzündungen und dem Mikrobiom entschlüsseln
Im Jahr 2022 waren in Europa nach Angaben der Weltgesundheitsorganisation(öffnet in neuem Fenster) fast 60 % der Erwachsenen und fast jedes dritte Kind übergewichtig oder adipös. Da es keinerlei Anzeichen für eine Abschwächung dieses Trends gibt, ist es an der Zeit, die Zusammenhänge zwischen den Veränderungen des Fettgewebes bei Adipositas und den möglichen Auswirkungen auf Entzündungen besser zu verstehen. „In den letzten zwei Jahrzehnten haben wir erkannt, dass die Beziehung zwischen den Funktionen und Interaktionen unserer Immunzellen und weißen Fettzellen, den Adipozyten, von entscheidender Bedeutung für unsere Gesundheit sind“, sagt Eran Elinav(öffnet in neuem Fenster), Professor am Fachbereich für Systemimmunologie am Weizmann-Institut für Wissenschaften(öffnet in neuem Fenster) und Leiter der Abteilung Mikrobiom und Krebs beim Deutschen Krebsforschungszentrum(öffnet in neuem Fenster). Elinav, der das vom Europäischen Forschungsrat(öffnet in neuem Fenster) (ERC) finanzierte Projekt ADIMMUNE koordiniert hat, erklärt, dass die genaue molekulare Struktur solcher Interaktionen, wie z. B. die Arten von Zelluntergruppen, die sich gegenseitig Signale senden, und die Art dieser Signale in den meisten Fällen unbekannt bleiben. „Dafür gibt es sowohl methodische als auch konzeptionelle Gründe. Die Technologie, mit der wir die Genexpressionsprofile einzelner Zellen charakterisieren können, die sogenannte Einzelzell-Transkriptomik, wurde beispielsweise erst kürzlich entwickelt. Doch der Prozess wird durch Fettzellen herausgefordert, die besondere Eigenschaften haben.“ Noch anspruchsvoller ist es, die Auswirkungen zu entschlüsseln, die die großen mikrobiellen Gemeinschaften, die in unserem Körper leben, unser Mikrobiom, auf die Kommunikationsnetze zwischen unseren Zellen, die Gewebedynamik und die damit verbundenen Auswirkungen auf unsere Gesundheit haben. „In unserem Projekt haben wir uns vorgenommen, all diese Herausforderungen zu bewältigen, indem wir die Zellinteraktion in adipösem Gewebe, ihre molekulare Struktur und ihre Regulierung durch das Darmmikrobiom funktionell entschlüsseln“, fügt Elinav hinzu, der das ElinavLab(öffnet in neuem Fenster) leitet.
Umfassende Analyseinstrumente
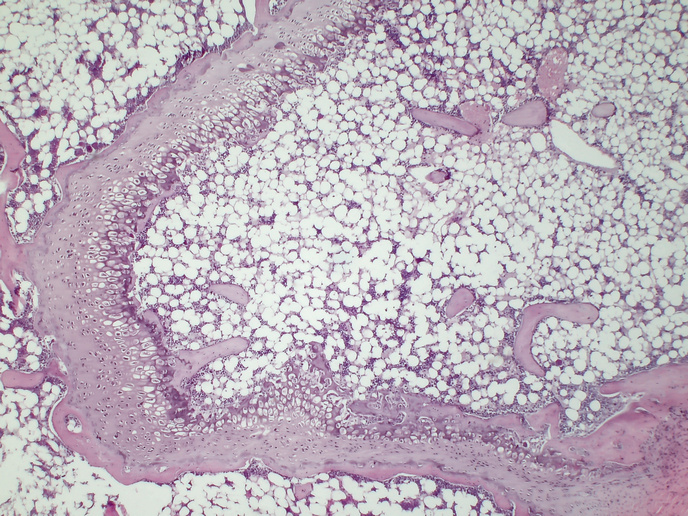
Im Rahmen des Projekts wurden kürzlich entwickelte (schnell generierte) genomische, mikrobiologische und gnotobiotische(öffnet in neuem Fenster) Instrumente mit hohem Durchsatz in neuen Mausmodellen eingesetzt. Gnotobiotisch bedeutet, dass die Mausmodelle keimfrei waren und dann mit bestimmten Bakterienstämmen besiedelt wurden. Im Ergebnis stand, dass das Team genau feststellen konnte, welche Bakterien eine bestimmte Interaktion auslösten. Sein umfassender Ansatz beinhaltete außerdem eine Analyse der Funktionsweise von Genen bestimmter Bakterien im Darmmikrobiom unter Verwendung von CRISPR(öffnet in neuem Fenster), mikrobieller Kulturomik(öffnet in neuem Fenster) und In-vivo-Stoffwechselanalysen. Für diese Studien nutzte ADIMMUNE sowohl schlanke als auch adipöse menschliche Freiwillige, die sich einer Fettbiopsie unterzogen.
Wechselwirkungen auf Einzelzellebene verstehen
„Wir haben viele bisher unbekannte Wechselwirkungen aufgedeckt“, fügt Elinav hinzu. Elinavs Team war in der Lage, bisher unbekannte Arten von Immunzellen im Fettgewebe der Mäusestämme sowie in schlanken und adipösen menschlichen Freiwilligen zu charakterisieren. Durch diese tiefgreifende Charakterisierung konnten projektintern mehrere unbekannte Zelluntergruppen, ihre jeweiligen Funktionen auf Einzelzellebene und die Kommunikationsnetze zwischen den verschiedenen Zellen ermittelt werden. „So konnten wir die Kettenreaktionen aufzeigen, bei denen eine Störung dieser zellulären Kommunikationsnetze und der Genexpression zur Entwicklung von Adipositas, Insulinresistenz und der damit eng verbundenen Lebererkrankung MASLD führt“, kommentiert Elinav. Seine Erkenntnisse über Adipositas sind in einer in der Fachzeitschrift „Cell“ veröffentlichten Abhandlung(öffnet in neuem Fenster) und jene über Fettleber in einer in der Fachzeitschrift „Nature Medicine“ veröffentlichten Abhandlung(öffnet in neuem Fenster) nachzulesen. Das Projektteam befasste sich auch mit einer der dramatischsten Formen der Adipositas, der sogenannten „Gewichtszunahme nach Rauchentwöhnung“: Dieser Mechanismus war bisher unbekannt. In einer großen Versuchsreihe an Mäusen konnte das Team zeigen, dass diese Gewichtszunahme wesentlich durch funktionelle Veränderungen im Darmmikrobiom während des aktiven Rauchens reguliert wird, wie in einem weiteren Artikel in „Nature“(öffnet in neuem Fenster) erläutert wird. „Wir haben die Moleküle ermittelt, über die die Mikroben mit den Fettzellen kommunizieren, um diese Auswirkungen auf Adipositas hervorzurufen“, bemerkt Elinav. „Interessanterweise könnten diese Moleküle, sobald sie entdeckt sind, auch die Entwicklung von Adipositas bei Nichtrauchern beeinflussen.“ Mit einem weiteren bahnbrechenden Forschungsstrang des Teams wurde das Zusammenspiel zwischen Hyperglykämie und Diabetes und dem erhöhten Risiko, das mit Virusinfektionen der Lunge verbunden ist, von Influenza bis COVID-19 untersucht. Es wird geschätzt, dass über 35 % der Menschen, die an einer schweren, lebensbedrohlichen COVID-19-Infektion leiden, Diabetes haben. „In einer Studie, die 2023 ebenfalls in „Nature“ veröffentlicht wird(öffnet in neuem Fenster) haben wir bei Mäusen nachgewiesen, dass die erhöhte Anfälligkeit für Virusinfektionen der Lunge bei Diabetes auf den hohen Blutzuckerspiegel in ihrem Blut zurückzuführen ist“, sagt Elinav. Er fand heraus, dass ein hoher Blutzuckerspiegel Auswirkungen auf die Stoffwechselkreise einer bestimmten Immunzelle in der Lunge hat, die als CDC1 bezeichnet wird. Letztlich führt dies zu einer veränderten Funktion, durch die das Virus das Immunsystem überwinden und eine schwere Infektion auslösen kann.
Funktionelle Erkenntnisse deuten Behandlungsmöglichkeiten an
Diese tiefen Einblicke in die molekularen Grundlagen der Kommunikation zwischen den Bakterien, die wir beherbergen, und den Immunzellen in unserem Fettgewebe haben zu funktionellen Erkenntnissen geführt, die Behandlungsmöglichkeiten aufzeigen. Elinav ist stolz auf die Projektergebnisse: „Der Aufbau eines solchen ursächlichen und mechanistischen Verständnisses gestattet die Ermittlung von therapeutischen Zielen und sogar von Molekülen, die die Krankheitsentwicklung beeinflussen. Ohne die kontinuierliche Unterstützung durch den ERC hätten wir das nicht geschafft.“