Zu molekularen Determinanten der Blutbildung
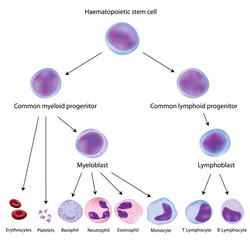
Transkriptionsfaktoren sind bei der Entwicklung und Homöostase die wichtigsten Akteure der hämatopoetischen Differenzierung. Werden zu geringe Mengen des Transkriptionsfaktors PU.1 exprimiert, kann es zu akuter myeloischer Leukämie (AML) kommen. Wie die Studien zeigen, wird die PU.1-Expression auf Chromatinebene geregelt. Allerdings ist wenig bekannt darüber, wie transkriptionell aktive oder stille Chromatinzustände entstehen und erhalten werden. Das EU-finanzierte Projekt PU.1 ANTISENSE (Role of antisense RNAs on PU. 1 regulation and hematopoiesis) untersuchte daher die Rolle nicht-kodierender Antisense-Transkripte bei der Genregulation von PU.1. Schwerpunkt war das Zusammenspiel zwischen diesen nicht-kodierenden RNA und bekannten epigenetischen Markern. Im ersten Schritt wurden Konzentrationen von PU.1 und seiner nicht-kodierenden Transkripte bei der Blutzelldifferenzierung quantifiziert und der Methylierungsstatus des PU.1-Genpromotors ermittelt. Dabei war bei verschiedenen Blutzelltypen eine deutlich umgekehrte Korrelation von PU.1-mRNA und Antisense-Transkription zu beobachten. Die Ablation nicht-kodierender Antisense-Transkripte veränderte die Chromatinstruktur und induzierte die PU.1-Expression und Differenzierung myeloischer Zellen. Ähnliche Beobachtungen wurden bei Antisense-Transkripten in Tiermodellen für Leukämie gemacht: die Leukämiezellen durchliefen eine Apoptose und die Mäuse überlebten länger. Weiterhin wurde ein neuer Mechanismus enthüllt, mit dem onkogene Fusionsproteine, die aus chromosomalen Translokationen stammen, die Antisense-Transkription und Methylierung von Promotoren induzieren. Insgesamt zeigte das Konsortium, wie die Antisense-Technologie therapeutisch genutzt werden kann, um die Differenzierung von Leukämiezellen zu verändern. Auch wurden neue Erkenntnisse darüber geliefert, wie chromosomale Translokationsprodukte die Leukämogenese fördern.