Pierwszy lek na raka trzustki stosowany w modelu mysim
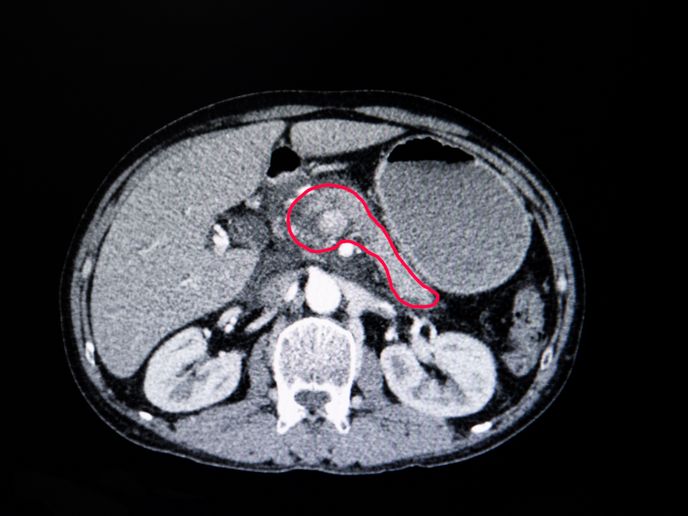
Pomimo że rak jest jedną z głównych przyczyn zgonów na całym świecie(odnośnik otworzy się w nowym oknie), większość nowotworów można leczyć, jeśli zostaną wykryte odpowiednio wcześnie. Nowotwory trzustki i płuc charakteryzują się jednak niskim wskaźnikiem przeżywalności. „Nowotwory te zwykle wywołują objawy dopiero w zaawansowanym stadium, co sprawia, że chirurgiczne usunięcie guza lub inne metody leczenia są mało skuteczne”, mówi Mariano Barbacid, koordynator finansowanego przez Europejską Radę ds. Badań Naukowych(odnośnik otworzy się w nowym oknie) projektu THERACAN. Ponieważ oba nowotwory są wywoływane przez określone mutacje genetyczne, znane jako onkogeny KRAS(odnośnik otworzy się w nowym oknie), zespół wykorzystał genetycznie zmodyfikowane myszy (ang. genetically engineered mouse, GEN) jako modele do badań in vivo i in vitro, aby przestudiować mechanizmy molekularne leżące u podstaw rozwoju guza. Badacze zidentyfikowali nowe cele terapeutyczne zaangażowane w sygnalizację onkogenną KRAS, wykazując, że komórki nowotworowe uległy regresji w obu typach nowotworów po wyeliminowaniu tych celów za pomocą manipulacji genetycznych.
Rola onkogenów KRAS
Według Barbacida, onkogeny KRAS są odpowiedzialne za około jedną czwartą wszystkich litych nowotworów u ludzi, w tym 25 % gruczolakoraka(odnośnik otworzy się w nowym oknie) (nowotworu, który rozpoczyna się w nabłonku wyściełającym gruczoły) i ponad 90 % nowotworów trzustki. Choć KRAS był jednym z pierwszych ludzkich onkogenów odkrytym w 1982 roku, sądzono, że ze względu na swój rozmiar i kształt, onkoproteiny KRAS nie mogą być celem leków. Dopiero niedawno firmom farmaceutycznym udało się zaprojektować leki selektywnie hamujące onkogen KRAS. Jednak, jak wyjaśnia Barbacid, możliwości ich wykorzystania wciąż są ograniczone. „Do tej pory amerykańska Agencja Żywności i Leków, AFD(odnośnik otworzy się w nowym oknie) zatwierdziła tylko dwa inhibitory dla jednej z mutacji KRAS. Niestety, wyniki badań klinicznych są umiarkowanie optymistyczne, bo zaledwie u połowy pacjentów z rakiem płuc nastąpiła regresja guza, a wskaźnik przeżywalności raka płuc po dwóch latach był taki sam, jak obserwowany w przypadku tradycyjnych terapii cytotoksycznych. Wyniki były jeszcze mniej imponujące w przypadku nowotworów trzustki, co pokazuje, że pilnie musimy opracować nowe inhibitory”.
Myszy zmodyfikowane genetycznie
Modele nowotworów GEM umożliwiły zespołowi usunięcie docelowych białek onkogenów, które mogą odgrywać ważną rolę w rozwoju nowotworu. Zespół wykazał, że wyeliminowanie RAF1, białka zaangażowanego w sygnalizację KRAS (która kontroluje proliferację komórek, w tym komórek nowotworowych), doprowadziło do regresji dwóch trzecich guzów płuc z mutacją KRAS. Co ważniejsze, wyeliminowanie zarówno RAF1, jak i receptora EGF (również będącego częścią procesu sygnalizacji), spowodowało całkowitą regresję wysokiego odsetka gruczolakoraków przewodów trzustkowych. Ponieważ nie ma selektywnych inhibitorów RAF1, które można by wykorzystać do walidacji wyników, zespół zrobił to na przykładzie modeli nowotworów, zwanych ksenograftami pochodzącymi od pacjentów(odnośnik otworzy się w nowym oknie) (ludzkie komórki nowotworowe hodowane u myszy). Natomiast lek przeciwnowotworowy, Gefitynib(odnośnik otworzy się w nowym oknie), był stosowany jako inhibitor EGFR. „Było to pierwsze doniesienie(odnośnik otworzy się w nowym oknie) na temat całkowitej regresji tego typu guza w jakimkolwiek modelu eksperymentalnym”, podkreśla Barbacid. „Choć efekt ten wykazaliśmy na modelu zwierzęcym bez bezpośredniego przełożenia na ludzi, możliwość obserwowania całkowitego zaniku guzów trzustki była dla nas niezwykle ekscytująca”.
Przyspieszenie dostępności nowych terapii
Ponieważ przejście od badań klinicznych do praktyki medycznej zajmuje zwykle wiele lat, projekty takie jak THERACAN odgrywają istotną rolę w identyfikacji obiecujących celów interwencji terapeutycznej. „Nasza praca pomaga przemysłowi farmaceutycznemu skoncentrować swoje zasoby, przyspieszając czas potrzebny na opracowanie selektywnych inhibitorów, co ostatecznie przyniesie korzyści pacjentom chorym na raka”, podsumowuje Barbacid. Zespół realizuje obecnie finansowany przez UE projekt mający na celu opracowanie nowych strategii genetycznych, dzięki którym możliwa będzie całkowita regresja wszystkich guzów płuc i trzustki z mutacją KRAS w modelach GEM.